
3.中央电视台经济频道《国宝档案》栏目曾经播出近代北京故宫的珍贵文物大量流失到海外的消息,与这些文物大量流失直接有关的事件最有可能是
①鸦片战争
②第二次鸦片战争 ③甲午中日战争 ④八国联军侵华战争
A.①② B.②③
C.③④
D.②④
2.自明朝万历年间,掌握纺织专业技能的人口开始进入苏州城。清晨,这些有技术的“机工”伫立桥头,等待拥有织机和机房的“机户”雇佣……暮息而归。这种现象也出现在江南其他一些城市。
这种现象的出现反映了 
A.生产力的发展
B.粮食产量增加富裕了一定的劳动力
C.劳动力专业化出现 D.资本主义生产关系普及
1.“(楚庄王十六年)伐陈,杀夏征舒。……已破陈,即县之。”“(韩桓惠王十年)我上党郡守以上党郡降赵。”这说明春秋战国时期
A.楚国和赵国分别分封了陈国和韩国
B.楚庄王完成了对全国的统一
C.秦国在新征服的地方设立了郡县
D.出现了分封制与郡县制并存的局面
21.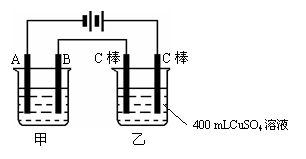 如图为为串联的甲、乙两电解池,试回答:
如图为为串联的甲、乙两电解池,试回答:
(1)若甲池利用电解原理在铁上镀银,则A是 极,B的电极材料是 ,电极反应式为 ,应选用的电解质溶液是 。
(2)若甲电解池阴极增重4.32g,则乙电解池中阳极上放出的气体在标准状况下的体积是 mL。
(3)若乙池中剩余溶液仍为400 mL,则电解后产物的物质的量浓度为 mol·L-1,溶液的pH为 。
20.(10分)水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
C (s) + H2O(g) CO (g) +H2
(g) △H= +131.3 kJ•mol-1
CO (g) +H2
(g) △H= +131.3 kJ•mol-1
(1)该反应的平衡常数K随温度的升高而___________(增大 / 减小 / 不变)。
(2)上述反应达到平衡后,将体系中的C (s)全部移走,平衡_______________(向左移 / 向右移 / 不移动)。
(3)上述反应在t0时刻达到平衡(如下图),若在t1时刻改变某一条件,请在下图中继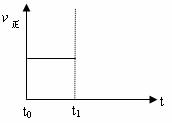 续画出t1时刻之后正反应速率(ν正)随时间的变化:
续画出t1时刻之后正反应速率(ν正)随时间的变化:
① 缩小容器体积(用实线表示)
② 降低温度(用虚线表示)
(4)一定温度下,三个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。
|
容器编号 |
c(H2O)/mol·L-1 |
c(CO)/mol·L-1 |
c(H2)/mol·L-1 |
ν正、ν逆比较 |
|
I |
0.06 |
0.60 |
0.10 |
ν正=ν逆 |
|
Ⅱ |
0.12 |
0.20 |
________ |
ν正=ν逆 |
|
Ⅲ |
0.10 |
0.20 |
0.40 |
ν正____ν逆 |
(5)CO和H2可合成甲醇。直接甲醇燃料电池(DMFC)由甲醇负极、氧正极和质子交换膜构成。在催化剂作用下甲醇被氧化为水和二氧化碳。甲醇用完后,只要补充甲醇就可以继续使用。因此,DMFC用作笔记本电脑、汽车等的能量来源时,它能够实现污染物的“零排放”。 DMFC的正极电极反应式为 ,DMFC的总反应式为 。
19.(9分)合成氨的反应原理为:N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
(1)合成氨工业中采取的下列措施中可用勒夏特列原理解释的是 (填序号)。
A.采用较高压强(20~50Mpa) B.采用500℃的高温
C.用铁触媒作催化剂 D.生成的氨液化分离,N2、H2循环压缩到合成塔中
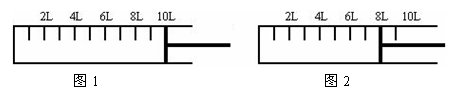
(2)如下图所示,将6mol N2和14mol H2充入一容积可变的密闭容器中发生反应。
反应开始时可滑动的活塞的位置如图1所示,当反应达到平衡时,活塞位置如图2所示。则达到平衡时,A的转化率为____________;该条件下反应的平衡常数为___________。
(3)体积为100mL、浓度为0.1 mol·L-1的两种溶液:A.NaOH溶液;B.氨水
①两种溶液相比较, 中水的电离程度大。(填序号,下同)
②用相同浓度的盐酸中和两种溶液至中性, 消耗的盐酸多。
③加水稀释两种溶液至pH为10, 加入的水的体积大。
18.(12分)不锈钢是由铁、铬、碳及众多不同元素所组成的合金,铁是主要成分元素,铬是第一主要的合金元素。其中铬的含量不能低于11%,不然就不能生成致密氧化膜CrO3防止腐蚀。
 (1)写出Fe2+的基态离子的电子排布式: ;基态碳(C)原子
(1)写出Fe2+的基态离子的电子排布式: ;基态碳(C)原子
的电子排布图为 。
(2) [Cr(H2O)4Cl2]Cl·2H2O中Cr的配位数为 ;已知CrO5中Cr为+6价,则CrO5的结构式为 。
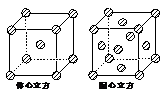 (3)H2O的分子构型为
;H2O分子间能形成氢键的原因是 。
(3)H2O的分子构型为
;H2O分子间能形成氢键的原因是 。
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如右图所示。体心立方晶胞与面心立方晶胞中实际含有的Fe原子个数之比为 。
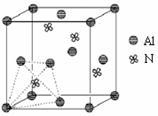
17.(11分)元素周期表中的第ⅢA、ⅣA、ⅤA族的部分
元素往往易形成原子晶体,氮化铝、磷化硼和砷化镓属于
此列,如氮化铝晶体中每个Al原子与4个N原子相连,每
个N原子也与4个Al原子相连,晶胞如右图所示。磷化硼
是一种受到高度关注的耐磨涂料,它可用作金属的表面保
护层;砷化镓属于第三代半导体,它能直接将电能转变为光
能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其10%。试回答下列问题:

(1)下列离子中最外层电子数不为8的是 (选填序号)。
A.P3— B.Al3+ C.Ti4+ D.Ga3+
(2)下列说法正确的是 (选填序号)。
A.硼和镓都属于S区元素,磷、砷属于P区元素
B.第一电离能:As>Ga Mg>Al
C.根据等电子体原理,砷化镓、磷化硼的晶胞与氮化铝晶体相同且类似于单晶硅
D.NH3沸点高于AsH3,其原因是NH3分子中共价键强度较大
(3)砷化镓可由(CH3)3Ga和AsH3反应得到, 该反应在700℃进行,反应的化学方程式为 ;
下列有机分子中碳原子的杂化方式与(CH3)3Ga分子中Ga原子的杂化方式相同的是 。(填序号)
 A.CH4 B.CH2=CH2
C.CH≡CH
D.HCHO E.
A.CH4 B.CH2=CH2
C.CH≡CH
D.HCHO E.
(4)请画出三溴化磷分子的路易斯结构式 ,请判断三溴化硼分子属于 (填“极性”“非极性”)分子。
15.(8分)10℃时,在烧杯中加入0.1mol/L的 NaHCO3溶液400mL,加热,测得该溶液的pH发生如下变化:
|
温度(℃) |
10 |
20 |
30 |
50 |
70 |
|
pH |
8.3 |
8.4 |
8.5 |
8.9 |
9.4 |
(1)甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为
;
 (2)乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度
(2)乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度
(填“大于”或“小于”)NaHCO3 ;
(3)丙同学认为,要确定上述哪种说法合理,只要把加热后的溶液冷却到10℃后再测定溶液pH,若pH________8.3(填“>”、“<”或“=”),说明甲正确,若pH________8.3(填“>”、“<”或“=”),说明乙正确;
(4)丁同学设计如下实验方案对甲、乙同学的解释进行判断:
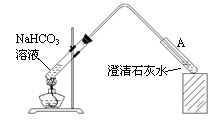
实验装置如图,加热煮沸NaHCO3溶液,发现试管A中产生沉淀,说明 (填“甲”或“乙”)推测正确;
(5)将一定体积0.1mol/L的 NaHCO3溶液置于烧杯中加热至微沸(溶液体积不变),测其pH为9.8;将烧杯冷却至室温,过一段时间(溶液体积不变)测得pH为10.1。据此资料可以判断_____(填“甲”或“乙”)推测正确,原因是___________________。
 16.(7分)BaSO4在水中存在沉淀溶解平衡BaSO4(s)
16.(7分)BaSO4在水中存在沉淀溶解平衡BaSO4(s) Ba2+(aq)+SO42-(aq),溶度积常数Ksp=c(Ba2+)·c(SO42-)。
Ba2+(aq)+SO42-(aq),溶度积常数Ksp=c(Ba2+)·c(SO42-)。
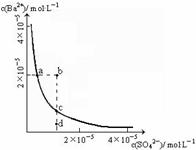
(1)某温度时,BaSO4的沉淀溶解平衡曲线如图所示。
下列说法正确的是___________________
A.加入Na2SO4可以使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
(2)在胃部透视时,服用的“钡餐”的主要成分是硫酸钡。在25℃时,硫酸钡的溶度积常数约为1.21×10—10。
①Ba2+是一种有毒的重金属离子,当人体中c(Ba2+)达到2×10—3mol·L-1时,就会对健康产生危害。硫酸钡作为“钡餐”的理由

。
②在25℃时,1L水中约能溶解0.0197g 碳酸钡,且胃液是酸性的, (能/不能)用碳酸钡代替硫酸钡作为“钡餐”,理由是


 四、(本题包括2小题,共23分)
四、(本题包括2小题,共23分)
14.常温下,下列各溶液的叙述中正确的是
A.0.1mol/L的醋酸钠溶液20mL与0.1mol/L盐酸10mL混合后溶液显酸性
c (CH3COO-)>c (Cl-)>c (H+)>c (CH3COOH)
B.pH=7的醋酸钠和醋酸混合液中:c(Na+)= c(CH3COO-)
C.0.1mol/L的醋酸的pH=a,0.01mol/L的醋酸的pH=b,则a+1>b
D.已知酸性HF>CH3COOH,pH相等的NaF与CH3COOK溶液中,
[c(Na+)-c(F-)]< [c(K+)-c(CH3COO-)]

第II卷(非选择题 共72分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com