
5. 理解盖斯定律的意义,能用盖斯定律和热化学方程式进行有关反应热的简单计算。
4. 认识热化学方程式的意义并能正确书写热化学方程式。
3. 了解反应热和焓变的涵义。
2. 认识化学反应过程中同时存在着物质和能量的变化,而且能量的释放或吸收是以发生变化的物质为基础的,能量的多少取决于反应物和生成物的质量。
1. 了解化学反应中能量转化的原因和常见的能量转化形式。
1、 为什么可燃物有氧气参与,还必须达到着火点才能燃烧?
3、基本概念
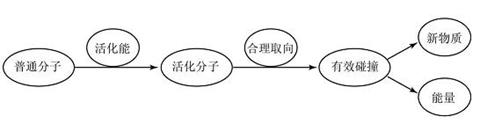
1)什么是有效碰撞?
引起分子间的化学反应的碰撞是有效碰撞,分子间的碰撞是发生化学反应的必要条件,有效碰撞是发生化学反应的充分条件,某一化学反应的速率大小与,单位时间内有效碰撞的次数有关
2)什么是活化分子?
具有较高能量,能够发生有效碰撞的分子是活化分子,发生有效碰撞的分子一定是活化分子,但活化分子的碰撞不一定是有效碰撞。有效碰撞次数的多少与单位体积内反应物中活化分子的多少有关。
3)什么是活化能?
活化分子高出反应物分子平均能量的部分是活化能,如图
活化分子的多少与该反应的活化能的大小有关,
活化能的大小是由反应物分子的性质决定,(内因)活化能越小则一般分子成为活化分子越容易,则活化分子越多,则单位时间内有效碰撞越多,则反应速率越快。
4)什么是催化剂?催化剂是能改变化学反应的速率,但反应前后本身性质和质量都不改变的物质,催化剂作用:可以降低化学反应所需的活化能,也就等于提高了活化分子的百分数,从而提高了有效碰撞的频率.反应速率大幅提高.
)归纳总结:一个反应要发生一般要经历哪些过程?
课堂思考题
2、化学反应原理所研究的范围是
1)化学反应与能量的问题
2)化学反应的速率、方向及限度的问题
3)水溶液中的离子反应的问题
4)电化学的基础知识
1、学习化学反应原理的目的
1)化学研究的核心问题是:化学反应
2)化学中最具有创造性的工作是:设计和创造新的分子
3)如何实现这个过程?
通常是利用已发现的原理来进行设计并实现这个过程,所以我们必须对什么要清楚才能做到,对化学反应的原理的理解要清楚,我们才能知道化学反应是怎样发生的,为什么有的反应快、有的反应慢,它遵循怎样的规律,如何控制化学反应才能为人所用!这就是学习化学反应原理的目的。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com