
3.(2008·全国Ⅰ理,11)已知三棱柱ABC-A1B1C1的侧棱与底面边长都相等,A1在底面ABC内的射影为△ABC的中心,则AB1与底面ABC所成角的正弦值等于 .
答案 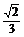
2.正方体ABCD-A1B1C1D1的棱长为1,O是A1C1的中点,则点O到平面ABC1D1的距离为 .
答案 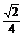
1.在正方体ABCD-A1B1C1D1中,M是AB的中点,则sin〈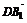 ,
,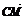 〉的值等于 .
〉的值等于 .
答案 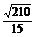
31.(20分)Ⅰ、葫芦科中一种称为喷瓜的植物,其性别不是由异型的性染色体决定,而是由3个复等位基因aD、a+、ad、决定的,aD对a+为显性,a+对ad为显性。它们的性别表现与基因型如下表所示:
由此可知,决定雄性、两性、雌性植株的基因依次是: 。
在雄性植株中能出现纯合体吗?请说明理由 。
Ⅱ、在某类动物中,毛色黑色与白色是一对相对性状。黑色为显性(W),白色为隐性(w)。下图示两项交配,亲代动物A、B、P、Q均为纯合子,子代动物在不同环境下成长,其毛色如下图所示,请据图分析回答:
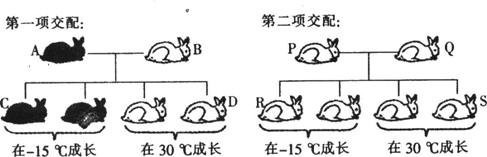
(1)动物C与动物D的表现型不同,其原因是___________。
(2)动物C与动物R交配得到子代:
①若子代在-15℃中成长,表现型最可能的比例是______________________。
②若子代在30℃中成长,表现型最可能是______________________。
(3)试推测和解释在寒冷的自然环境中,黑色皮毛对动物的生存有什么好处? ___________________________________________________________。
(4)现有突变体X和Y,假设两种纯合突变体X和Y都是由控制黑色的W基因突变产生的。检测由突变基因转录的mRNA,发现X的第三个密码子中第二碱基由G变为U,Y的第三个密码子的第二碱基前多了一个U。与正常黑毛动物相比,这两个突变体中________________的毛色变化可能小些,试从蛋白质水平解释原因:________________________________。
2009年浙江省百校联考模拟卷
 杭 州 第 二 中 学
杭 州 第 二 中 学
杭州新理想高考研究中心
杭州新天地书报刊发行公司总发行
30.(24分)人的血清白蛋白(HSA)在临床上需求量很大,通常从人血中提取。但由于艾滋病病毒(HIV)等人类感染性病原体造成的威胁与日俱增,使人们对血液制品顾虑重重。应用基因工程和克隆技术,将人的血清白蛋白基因转入奶牛细胞中,利用牛的乳汁生产血清白蛋白,既提高了产量,又有了安全保障。下图是利用奶牛乳汁生产人类血清白蛋白的图解,根据下图回答:
(1)一般情况下,良种奶牛所产生的能用于体外受精的卵母细胞往往数量不足,请举出一种可以获得更多卵母细胞的方法: 。
(2)在基因工程中,我们称②为 ,在②进入③之前要用 等工具来构建基因表达载体,能实现②进入③的常用方法是 。
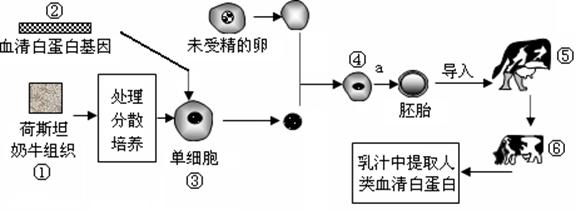 (3)图中①一般经
处理可以得到③,从③到④过程中一般利用未受精的卵细胞去核后做为受体,而不用普通的体细胞,原因是:
。
(3)图中①一般经
处理可以得到③,从③到④过程中一般利用未受精的卵细胞去核后做为受体,而不用普通的体细胞,原因是:
。
(4)过程a是进行动物早期胚胎的体外培养,培养液中除了含有各种无机盐、维生素、葡萄糖、氨基酸、核苷酸等营养成分外,还要添加 。
(5)⑥是⑤生出的后代,那么⑥的遗传性状和 最相拟,为什么? ,如果②的数量太少,常用 来扩增。 要实现⑥批量生产血清白蛋白,则要求③的性染色体是 ,利用该方法得到的动物叫做 。
|
性别类型 |
基因型 |
|
雄性植株 |
aD a+、aD ad |
|
两性植株(雌雄同株) |
a+ a+、 a+ ad |
|
雌性植株 |
ad ad |
29.(15分)已知:R-NH2或R1-NH-R2的性质与NH3相似,能与酸反应生成离子化合物。有机物A结构简式如下图所示:
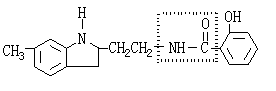
有机物A在稀硫酸中受热会水解成B、C两种产物,B是一种离子化合物,C是一种共价化合物。
(1)A的分子式为 。在A的结构简式中虚线框内的结构名称为 。
(2)写出C跟碳酸氢钠反应的化学方程式 。
(3)C的同分异构体中,属于酚类也属于酯类的化合物有 种。
(4)某类有机物,属于C的同分异构体,分子中有苯环且苯环上连有三个取代基。写出这类有机物中含氧官能团的名称 。
(5)写出B跟过量氢氧化钠溶液加热的反应的离子方程式 。
28. (14分)下图是化学研究性学习小组设计的铜与稀硝酸反应的两个实验装置图。其中装置Ⅰ为甲同学设计。
(14分)下图是化学研究性学习小组设计的铜与稀硝酸反应的两个实验装置图。其中装置Ⅰ为甲同学设计。
请回答下列问题:
(1)铜与稀硝酸反应的离子方程式为 。
(2)乙同学认为装置Ⅰ中收集的气体不能确定铜与稀硝酸反应生成的是NO气体,理由是
。于是他设计装置Ⅱ,其中装铜片的是气球。
(3)如何检验装置Ⅱ的气密性?
。
(4)化学研究性学习小组的其它同学对上述实验进行了研究,认为装置Ⅱ虽然作了改进,但如果按装置Ⅱ进行实验,还是会出现三个问题,需要作相应改进措施。请你帮助他们填写相关内容。
问题一: 。
措施:加热或 。
问题二:试管中的气体是淡棕红色,而不是无色。
措施: (填具体操作。不能增加装置)。
问题三: 。
措施: 。
27.(14分)红矾钠(重铬酸钠:Na2Cr2O7·2H2O、具有强氧化性)是重要的基本化工原料,在印染工业、电镀工业和皮革工业中作助剂,在化学工业和制药工业中也用作氧化剂,应用领域十分广泛。实验室中红矾钠可用铬铁矿(主要成分:FeO·Cr2O3,含有氧化铝、二氧化硅等杂质)利用以下过程来制取。
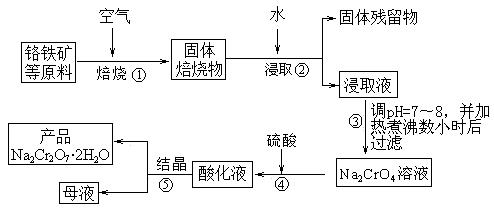
(1)步骤①中反应的化学方程式为:
1 ▲ FeO·Cr2O3(s)+
▲ Na2CO3(s)+ ▲ O2  ▲ Na2CrO4(s)+
▲ Fe2O3(s)+ ▲ CO2;△H < 0
▲ Na2CrO4(s)+
▲ Fe2O3(s)+ ▲ CO2;△H < 0
上述反应中被氧化的元素是 ▲ (填元素符号), 配平上述方程式,该反应的化学平衡常数的表达式为 ▲ 。
配平上述方程式,该反应的化学平衡常数的表达式为 ▲ 。
(2)已知在酸性条件下,下列物质氧化KI时,自身发生如下变化:
a.Fe3+ → Fe2+; b.MnO4ˉ→ Mn2+;c.Cl2 → 2Clˉ;d.HNO3 → NO;e.Cr2O72ˉ→Cr3+
如果分别用等物质的量的这些物质氧化足量的KI,得到I2的量从多到少依次为(填序号) ▲ 。
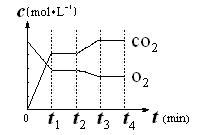
(3)如下图表示该反应在t1时达到平衡、在t2时因改变某个条件而发生变化的曲线。由图判断,反应进行至t2 min时,曲线发生变化的原因是 ▲ (用文字表达)。
(4)步骤②中所得的浸取液显碱性,其中除含有Na2CrO4外还含有铝、硅元素的化合物,它们的化学式可能是 ▲ 、 ▲ 。
(5)已知步骤④中相关反应的离子方程式为:
2CrO42-+2H+
 Cr2O72-+ H2O
Cr2O72-+ H2O
(黄色) (橙红色)
加入下列哪些物质能使酸化混合液黄色加深的是: ▲ 。
A.H2O B.Na2CO3 C.Na2SO3 D.NaOH
26.(15分)四种短周期元素A、B、C、D的性质或结构信息如下。
信息① 原子半径大小:A>B>C>D
信息② 四种元素之间形成的某三种分子的比例模型及部分性质:

甲:是地球上最常见的物质之一,是包括人类在内所有生命生存的重要资源,也是生物体最重要的组成部分。
乙:无色,无味而易燃,是常见的能源物质。
丙:有强氧化性,可以用于消毒杀菌。
请根据上述信息回答下列问题。
(1)甲、乙、丙中含有的共同元素是 (填名称)。丙溶于甲中可生成一种10电子的微粒,用化学用语表示这一过程_____________________________。
(2)B元素在周期表中的位置 ,写出A原子的电子式 。
(3)举例说明B元素形成的单质晶体类型可能有 。
(4)A、B、C可分别与D形成化合物a、b、c。这些化合物分子组成的物质沸点高低顺序可能为 。
(5)A的单质可跟与之同周期元素形成某种氧化物的水溶液发生氧化还原反应,写出相关反应的离子方程式_________________________。
25.(22分)如图甲所示,在水平放置的两平行金属板的右侧存在着有界的匀强磁场,磁场方向垂直于纸面向里,磁场边界MN和PQ与平行板的中线OO′垂直。金属板的下极板接地,上极板的电压u随时间变化的情况如图乙所示,匀强磁场的磁感应强度B=1.0×10-2T。现有带正电的粒子以v0=1.73×105m/s的速度沿两板间的中线OO' 连续进入电场,经电场后射入磁场。已知带电粒子的比荷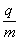 =1.0×108C/kg,在t=0.10s时刻射入电场的带电粒子恰能从平行金属板边缘穿越电场射入磁场。假设在粒子通过电场区的极短时间内极板间的电压可以看作不变,粒子的重力和粒子间相互作用力均可以忽略不计(结果保留两位有效数字)。
=1.0×108C/kg,在t=0.10s时刻射入电场的带电粒子恰能从平行金属板边缘穿越电场射入磁场。假设在粒子通过电场区的极短时间内极板间的电压可以看作不变,粒子的重力和粒子间相互作用力均可以忽略不计(结果保留两位有效数字)。
(1)求t=0.10s时刻射入电场的带电粒子射出电场时速度的大小和方向。
(2)为使t=0.10s时刻射入电场的带电粒子不会由磁场右边界射出,该匀强磁场区的宽度至少为多大?
 (3)若磁场的宽度足够大,对任何时刻以v0射入电场的带电粒子,设其射入磁场的入射点和从磁场射出的出射点间的距离为x,则x的大小是否相等?若不相等,求出x的变化范围;若相等,求出x的大小。
(3)若磁场的宽度足够大,对任何时刻以v0射入电场的带电粒子,设其射入磁场的入射点和从磁场射出的出射点间的距离为x,则x的大小是否相等?若不相等,求出x的变化范围;若相等,求出x的大小。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com