
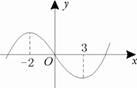
6.函数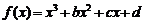 图象如图,则函数
图象如图,则函数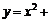
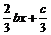 的单调递增区间为( )
的单调递增区间为( )
 A.
A.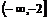 B.
B.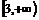
C.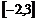 D.
D.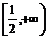
5.一个人以6米/秒的速度去追停在交通灯前的汽车,当他离汽车25米时,交通灯由红变绿,汽车以1米/秒的加速度匀加速开走,那么( )
A.此人可在7米内追上气车
B.此人可在10米内追上汽车
C.此人追不上汽车,其间距离最近为5米
D.此人追不上汽车,其间距离最近为7米
4.函数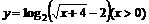 的反函数是( )
的反函数是( )
A.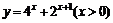 B.
B.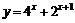 (x∈R)
(x∈R)
C.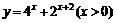 D.
D.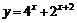 (x∈R)
(x∈R)
3.已知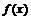 =
=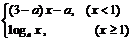 是(-∞,+∞)上的增函数,那么a的取值范围是(
)
是(-∞,+∞)上的增函数,那么a的取值范围是(
)
A.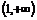 B.
B.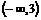 C.
C.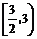 D.(1,3)
D.(1,3)
2.已知x∈R,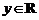 则“
则“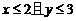 ”是“
”是“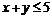 ”的( )
”的( )
A.充分不必要条件 B.必要不充分条件
C.充要条件 D.既不充分又不必要条件
1.函数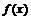
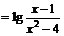 的定义域为( )
的定义域为( )
A.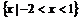 B.
B.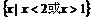
C.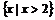 D.
D.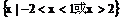
21.(12分)取等物质的量浓度的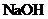 溶液两份
溶液两份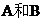 ,每份10
,每份10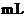 ,分别向A、B中通入不等量的
,分别向A、B中通入不等量的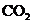 ,再继续向两溶液中逐滴加入
,再继续向两溶液中逐滴加入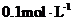 的盐酸,标准状况下产生的
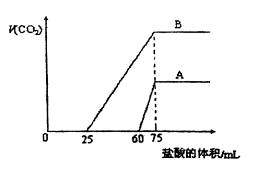
的盐酸,标准状况下产生的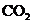 气体体积与所加的盐酸溶液体积之间的关系如下图所示,试回答下列问题:
气体体积与所加的盐酸溶液体积之间的关系如下图所示,试回答下列问题:
(1)原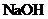 溶液的物质的量浓度为
溶液的物质的量浓度为
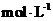 。
。
(2)曲线A表明,原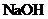 溶液中通入
溶液中通入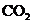 后,所得溶液中的溶质为(写化学式)
后,所得溶液中的溶质为(写化学式)
;其物质的量之比为 。
(3)曲线B表明,原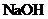 溶液中通入
溶液中通入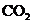 后,所得溶液加盐酸后产生
后,所得溶液加盐酸后产生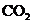 气体体积(标准状况)的最大值为
气体体积(标准状况)的最大值为
 。
。
20.(14分)A、B、C、D、E、F均是元素周期表中按原子序数依次增大的前20号元素,其中只有A、D和B、E分别是同一主族元素,B、E两元素原子核中质子数之和是A、D两元素原子核中质子数之和的两倍,又知六种元素的单质中有三种气体、三种固体。部分元素在元素周期表中的相对位置关系如下:
|
|
C |
|
E |
|
请回答:
(1)D、E组成的常见的化合物,其水溶液呈碱性,原因是
(用离子方程式表示)。
(2)E的单质能跟D的最高价氧化物对应水化物的热浓溶液发生氧化还原反应,生成的两种正盐的水溶液均呈碱性,写出该氧化还原反应的离子方程式 。
(3)C、F所形成的化合物为离子化合物,其晶体结构模型如下:
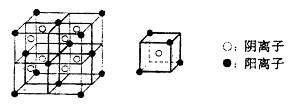
该离子化合物的化学式为 。
(4)甲、乙两种负一价双原子阴离子,分别含有A、B、E中的两种元素,其中甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为 。
(5)4.0gE的单质在足量的B的单质中完全燃烧,放出37.0kJ热量,写出其热化学方程式:
。
(6)用A元素的单质与B元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的金属惰性电极浸入KOH浓溶液,两极均有特制的防止气体透过的隔膜,在A极通入A的单质,B极通入B的单质,则A极是该电池的 极;B极的电极反应式是 。
19.(12分)某100mL溶液中仅含下表离子中的5种离子(不考虑水的电离及离子的水解),且各离子的物质的量均为0.1mol。
|
阴离子 |
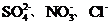 |
|
阳离子 |
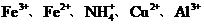 |
①若向原溶液中加入KSCN溶液,无明显变化。
②若向原溶液中加入过量的盐酸,有气体生成,溶液中阴离子种类不变。
③若向原溶液中加入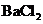 溶液,有白色沉淀生成。
溶液,有白色沉淀生成。
试回答下列问题:
(1)原溶液中所含阳离子是(写离子符号,后同) ,阴离子是 。
(2)若向原溶液中先加入少量盐酸,再滴入KSCN溶液,实验中所发生反应的离子方程式是 、 。
(3)若向原溶液中加入足量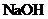 溶液,充分反应后静置一段时间,过滤、洗涤、灼烧,最终所得固体的质量是
。
溶液,充分反应后静置一段时间,过滤、洗涤、灼烧,最终所得固体的质量是
。
(4)向原溶液中加入足量盐酸后,用排水法收集所产生的气体并使气体恰好充满容器,仍将容器倒置于水槽中,再向容器中通入
mL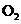 (气体体积均指标准状况),能使溶液充满该容器。
(气体体积均指标准状况),能使溶液充满该容器。
18.(14分)已知A、B、C、D是短周期中的四种非金属元素,它们的原子序数依次增大,四种元素的原子最外层电子数之和为16,A与B、C、D之间均可形成含有10个电子或18个电子的化合物,且A、D组成的化合物在常温下呈液态。
(1)A、C两种元素组成的10个电子化合物的分子式是 ,分子的空间构型是 ,属于 (填极性、非极性)分子。
(2)A、C、D三种元素原子半径由小到大的顺序是(用元素符号表示) ;由A、C、D三种元素组成的某种盐溶液呈酸性,用离子方程式解释其原因
。
(3)A、B、D三种元素形成的具有18个电子的化合物的结构简式为 。
(4)这四种元素可组成原子个数比为5:1:1:2(按A、B、C、D顺序)的化合物,其名称为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com