
气体的收集装置通常分为排水集气法、向上排空气法和向下排空气法三种:
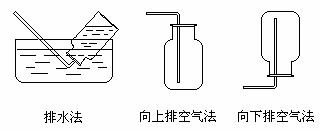
1.凡是 的气体都可以用排水法收集。用排水法集气时,盛满水的集气瓶应 在水槽里,收集满气体后,应在水下用 盖严,用此法收集得到的气体纯度 。
2.实验室制取气体的典型装置有时候还要根据具体情况加以选择或改进。
(1)制取乙炔气体时,由于反应剧烈,且产生大量泡沫,故应在选择 B 中的 ② 装置时,应在试管内的导管口 ,也可将试管换成 。
(2)加热液体混合物制取气体时,应在圆底烧瓶中加入少量 ,目的是 ;若制取少量气体时,则应 。
(3)右图①是目前市售的小型简易气体发生装置,该装置的功能与上图中 相同;若制取少量这类气体(无须加热)时,还可用右②这种最简易的装置,该装置的缺点是 。
实验室典型的气体发生装置有三大类:
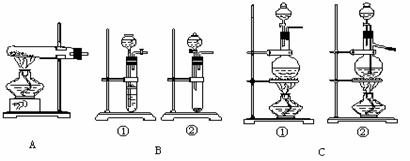
1.气体发生装置的选择要根据反应物的状态和反应条件来决定。
(1)选择 A 装置时,反应物应是 ,反应条件是 。
(2)选择 B 中的 ① 装置时,反应物应是 ,反应条件是 ;选择 B 中的 ② 装置时,反应物应是 ,反应条件是 。
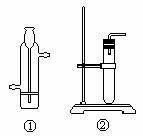 (3)选择 C 中的 ① 装置时,反应物应是
,反应条件是
;选择 C 中的 ② 装置时,反应物应是
,反应条件是
。
(3)选择 C 中的 ① 装置时,反应物应是
,反应条件是
;选择 C 中的 ② 装置时,反应物应是
,反应条件是
。
实验室制备各种气体应以实验室常用药品为原料,以安全、方便、经济为原则。同时在选择气体制备原理时,还应考虑使用该原理制取气体的装置要简单,所制得的气体要纯净。请你写出中学化学实验室制取下列 9 种气体的化学反应方程式:
|
序号 |
气体 |
反应原理 |
序号 |
气体 |
反应原理 |
|
1 |
O2 |
|
6 |
NO |
|
|
2 |
H2 |
|
7 |
NO2 |
|
|
3 |
CO2 |
|
8 |
C2H4 |
|
|
4 |
Cl2 |
|
9 |
C2H2 |
|
|
5 |
NH3 |
|
|
|
|
酸性的化学肥料不能和碱性肥料混用,如硝酸铵和草木灰(主要有效成分为K2CO3)不能混合施用,因NH4NO3水解是酸性,K2CO3水解是碱性,混合促进水解,降低肥效。
试题枚举
[例1]2000年诺贝尔物理学奖授予为现代信息技术作出贡献的三位科学家,表彰他们为信息技术所作的基础性研究,特别是他们发明的快速晶体管、激光二极管和集成电路芯片。与该项奖相关的基础知识,下列说法错误的是:
A 晶体管由半导体材料制成
B 二极管具有电流放大作用
C 集成电路使电子设备小型化,功能多样化
D 现代信息技术的发展与物理学新发现密切相关
解析:本题结合2000年物理学奖的奖项内容,设置了与中学知识相关的四个选项,考查考生对半导体。激光二极管、集成电路和信息技术等知识的理解能力和判断能力。由于二极管具有单向导电性,不具备电流放大作用,故选项B错误。
答案:B
[例2]录像用的高性能磁带的磁粉,主要材料之一是由三种元素组成的化学式COxFe3-xO3+x的化合物。已知氧为-2价,钴(Co)和铁可能呈现+2价或+3价,且上述化合物每种元素都只有一种化合价,则x值为____________,铁的化合价为____________,钻的化合价为____________。
解析:本题有三个未知量,只能根据化合价规则建立一个方程,但一个方程中有三个未知数,要解这个方程必然要联系化学含义。设化合物中钴的化合价为a价,铁的化合价为b价,根据化合物中各元素的化合价代数和为零的原则,可建立如下方程:ax+b(3-x)-2(3+x)=0,整理得x=(3b-6)/(b+2-a)。依题意,b只能取2或3,当b=2时,无意义,故b只能取3,此时x=3/(5-a),仅当a=2时,x=1(整数)有意义。
答案:X为2,铁的化合价为3,钴的化合价为2。
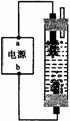 [例3]某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是
[例3]某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是
A a为正极,b为负极;NaClO和NaCl
B a为负极,b为正极;NaClO和NaCl
C a为阳极,b为阴极;HClO和NaCl
D a为阴极,b为阳极;HClO和NaCl
解析:本题从电极名称和电解后溶液的主要成分两方面进行设问。首先,a、b电极为电源上的电极,原电池的电极名称与电解池的电极名称不同,应为正极或负极,排除选项C和D。其次,如图所示的电解池中,要使Cl2能被溶液“完全吸收”,是让上边一个电极产生Cl2 ,还是让下边一个电极产生Cl2 ?让阳极产生的Cl2通过阴极附近的碱溶液,Cl2 才能被完全吸收。第三,电解池中产生Cl2的阳极对应的电源电极名称是正极。
答案:B
[例4]某工厂用氨氧化法可制得质量分数为50%的硝酸,脱水后可进一步得到90%的硝酸,若以17t液氨为原料生产硝酸(假设反应及脱水过程中各反应物及生成物均无损耗)。试填写下列空白。
(1)若该厂只生产50%的硝酸,计算得到的理论上需水的质量为 t。
(2)若该工厂只生产90%的硝酸,计算理论上需水质量 t。
(3)若该厂同时生产50%和90%两种硝酸,它们的质量比为
x=m1/m2(m1、m2分别表示50%,90%硝酸的质量)
①写出理论所需水量y与质量比x的函数关系式y= 。
②当进出水量平衡时x= ,此时,两种产品的总质量为 。
 解答: (1)NH3+2O2 HNO3+H2O
解答: (1)NH3+2O2 HNO3+H2O
17g 63g 18g
17t x′t y′t
得m=63t n=18t
则补加水at:
50%·(a+18+63)=63
得a=45t
(2)设补加水bt:
则90%·(b+18+63)=63
得b=-11t(即脱水11t)


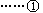 (3)①
(3)①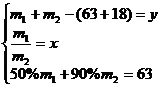
得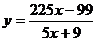
②当进出水平衡时,即不需补加水,即 y=0
代入上式得 x=11∶25
将 y=0 代入上述①式
m1+m2=81
得:两种产品总质量为81t
|
三阶段 |
SO2制取和净化 |
SO2转化为SO3 |
SO3吸收和H2SO4的生成 |
|
三方程 |
|
|
|
|
三设备 |
|
|
|
|
有 关 原 理 |
矿石粉碎,以增大__ __________________________________ |
逆流原理(热交换器中:管___
___气体__,管_____气体__)目的:冷气预热至_____℃以上,热气冷却至____℃以下. |
逆流原理(浓硫酸____,气体____)增大接触面积(吸收塔内入填料)以充分吸收。 |
|
设备中排出的气 体 |
炉气:SO2.N2.O2.矿尘(除尘).砷硒化合物(洗涤). H2O气(干燥)…… 净化气:SO2.N2.O2 |
|
尾气:
不能直接排入大气中 |
|
说 明 |
矿尘.杂质:易使催化剂“中毒” H2O气:腐蚀设备、影响生产 |
接触室内压强为____压。 为什么?__________ |
实际用___________吸 收SO3,以免形成___ |
3.离子交换膜法制烧碱
离子交换膜的特性:只允许阳离子通过,而阻止阴极离子和气体通过。
2.饱和食盐水的精制:电解前应除去食盐溶液中的Ca2+、Mg2+、SO42―等杂质离子,加入试剂依次为NaOH溶液、BaCl2溶液、Na2CO3溶液、稀盐酸(或将BaCl2溶液和NaOH溶液的顺序互换)。
离子交换膜电解槽主要由阳极(用金属钛网制成,涂有钛、钌等氧化物涂氯碱工业--电解饱和食盐水制取氯气和烧碱。
1.原理:阳极(用石墨):2Cl― -2e-=Cl2 ↑ 阴极(用Fe):2 H+ + 2e-= H2 ↑
总反应:2NaCl + 2 H2O  2NaOH
+H2↑+Cl2↑
2NaOH
+H2↑+Cl2↑
2.合成氨生产工艺:生产流程 。
原料气的制备 。其中生产的氨气液化分离,原料气循环利用。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com