
26、(2分)Cl2;KI
35、有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大, 已知A和C原子最外层只有一个电子,C燃烧时的焰色反应是黄色,C的单质在空气中加热与B的单质充分反应可以产生淡黄色固态化合物,A单质与D单质可以发生化合反应,且反应条件可以是点燃或者光照,燃烧时发出苍白色火焰。根据以上叙述回答:
(1)写出各元素名称:A: ;B: ;C: ; D: 。
(2)写出化学方程式:①C+B: ,
②A+D: 。
附加题:
1:一碳化学是以分子中只含有一个碳原子的化合物(如CO、CH4等)为原料合成一系列化工原料和燃料的化学。下图为一碳化学的一种简易流程,回答下列问题:
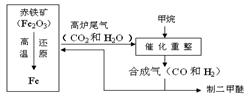 (1)利用高炉尾气中的水蒸气与甲烷催化重整得到合成气,化学方程式为
。
(1)利用高炉尾气中的水蒸气与甲烷催化重整得到合成气,化学方程式为
。
(2)课外小组的同学从上述流程中收集到一瓶“合成气”,用下图所示装置进行研究(已知高温条件下,甲烷和氧化铁反应生成CO2和H2O,3H2 +Fe2O3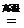 3H2O + 2Fe),以确定“合成气”的成分。
3H2O + 2Fe),以确定“合成气”的成分。
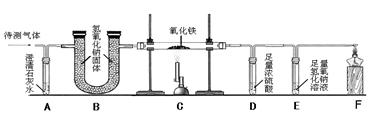
①A中澄清石灰水变浑浊②C中一氧化碳与氧化铁反应的化学方程式为 。
③B装置中盛有足量的氢氧化钠颗粒,其作用是 。
④实验测量D和E的质量反应后分别增加9.0g和8.8g,推测原混合气体的组成为(假设混合气在C装置中反应完全) (填字母)。
A.CO、H2、CO2 B.CO、H2、CH4
C.CO、H2、CH4、CO2 D.CO2、H2、CH4
⑤其中气体体积比______________________________
2:将0.2mol某一元醇烃完全燃烧后,生成的气体缓慢通过盛有0.5L 2mol/L的氢氧化钠溶液中,生成两种钠盐的物质的量之比刚好为1:3,
1:求该一元醇的化学式。
2:该醇有几种同分异构体。
3:写出能被氧化为醛的化学方程式:
每小题只有一个选项符合题意(每小题2分,共50分。)
34.下表是元素周期表的一部分,针对表中所列①-⑩元素,填写下列空白。
|
IA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
||
|
二 |
|
|
|
① |
② |
③ |
④ |
|
||
|
三 |
⑤ |
⑥ |
⑦ |
|
|
⑧ |
⑨ |
⑩ |
⑴单质性质最不活泼的元素的原子结构示意图是 。
⑵地壳中含量最多的元素在元素周期表中的位置为第 周期 族。
⑶元素①的气态氢化物的化学式为 ,其中含有的化学键的类型为 ,该化合物与氯气发生反应的类型是 反应。
⑷第三周期元素的最高价氧化物对应水化物中,酸性最强的是 (填化学式,下同),具有两性的是 。
⑸元素⑦的氧化物与氢氧化钠溶液反应的产物是 。
⑹某元素一价阳离子的核外有10个电子,该阳离子的离子符号是 。
⑺用电子式表示元素⑤与④的化合物的形成过程: ,
⑻工业上用②元素的单质合成其氢化物的化学方程式是 。
⑼写出⑧元素氢化物与其最高价氧化物对应水化物浓溶液反应生成淡黄色沉淀的化学方程式: 。
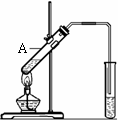
33、“酒是陈的香”,就是因为酒在储存过程中生成了
有香味的乙酸乙酯。在实验室我们也可以用如图
所示的装置制取乙酸乙酯,在试管A中加入的试
|
回答下列问题:
⑴写出制取乙酸乙酯的化学反应方程式
。
⑵装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止 。
⑶若要把制得的乙酸乙酯分离出来,应采用的实验操作是 。
32、来自石油的基本化工原料之一--乙烯,有着十分广泛的用途。请回答:
⑴乙烯的结构简式 。
⑵可以用来鉴别甲烷和乙烯的试剂是 (填序号)。
①水 ② 稀硫酸 ③溴的四氯化碳溶液 ④酸性高锰酸钾溶液
⑶在一定条件下,乙烯能与水反应生成有机物A。A的分子式是 ,其反应类型是 反应(填“取代”或“加成”)。
⑷有机物A和乙酸都是生活中常见的有机物。
A可以与下列物质中的 (填序号)反应,被直接氧化成乙酸。
①水 ② 稀硫酸 ③溴的四氯化碳溶液 ④酸性高锰酸钾溶液
⑸乙烯是一种植物生长调节剂,可以用乙烯作为水果的 剂;日常生活中所
 使用的塑料食品袋,其材质是
(填“聚乙烯”、“聚氯乙烯”)。
使用的塑料食品袋,其材质是
(填“聚乙烯”、“聚氯乙烯”)。
31、海洋是非常巨大的资源宝库,海水占地球总储水量的97.2 %,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源。
(1)海水中存在大量的氯化钠,氯化钠的电子式 。
(2)目前,国际上实际采用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变为蒸汽,蒸汽经冷却而得高纯度淡水。由此可判断蒸馏法是
(填“物理变化”或“化学变化”)。
(3) 从海水中可以提取溴,但得到的液溴中常常溶有少量氯气,除去氯气应该采用的方法是 (填序号)。
①加适量的KI溶液 ②通入溴蒸气
③加入适量的NaOH溶液 ④加入适量的NaBr溶液
(4)工业上利用电解饱和食盐水可制得重要化工产品。反应式为:2 NaCl +2H2O
电解 2NaOH+Cl2↑+H2↑,该反应的离子方程式为 ,
该反应从能量转化上分析应属于 ;利用电解所得气体制36.5 %的浓盐酸1000t,最少需消耗食盐 t。
30、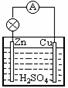 原电池的反应实质是
。写出铜锌原电池
原电池的反应实质是
。写出铜锌原电池
(稀硫酸为介质)的电极反应:负极 ,
正极 。
29、在一块大理石(主要成分是CaCO3)上,先后滴加1mol/LHCl溶液和0.1mol/LHCl溶液反应快的是滴加了 的,先后滴加同浓度的热盐酸和冷盐酸,反应快的是滴加 的,用大理石块和大理石粉分别跟同浓度的盐酸起反应,反应快的是用了 的。
28、某同学进行如下实验,探究化学反应中的能量变化。
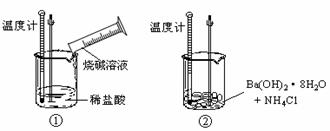
通过实验测出,反应前后①烧杯中的温度升高,②烧杯中的温度降低。由此判断NaOH溶液跟盐酸的反应是 (填 “吸热”或“放热”)反应,Ba(OH)2·8H2O跟NH4Cl的反应是 (填“吸热”或“放热”)反应。试写出①中反应的离子方程式 。
27、冶炼金属常用以下几种方法:①以C、CO或H2做还原剂 ②利用铝热反应原理还原 ③电解法 ④热分解法。下列金属各采用哪种方法冶炼最佳(填写序号)。
(1)Fe、Zn、Cu等中等活泼金属 。
(2)Na、Mg、Al等活泼或较活泼金属 。
(3)Hg、Ag等不活泼金属 。
(4)V、Cr、Mn、W等高熔点金属 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com