
4. (1)2CaO2+2H2O====2Ca(OH) 2+O2↑(2分)
(2)冰水浴冷却(或将反应容器浸泡在冰水中)(2分)
(3)NH4Cl A(各2分,共4分)
(4)稀硝酸酸化的硝酸银溶液(2分)
(5)①溶液由蓝色变为无色(2分)
②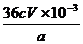 (2分)
(2分)
5.
I 化学兴趣小组对用铜制取硫酸铜晶体的试验方案作研究。甲组同学将铜粉投入盛有稀硫酸的容器中,不发生反应。他们向容器底部缓缓鼓入氧气,溶液慢慢变蓝色,若在溶液中放置有些铂丝,反应速率明显加快。此时,其他组的同学提出方案如下:
乙组: 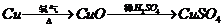 丙组:
丙组: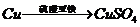
丁组:
戊组: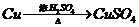
(1)甲组试验可用一个化学反应方程式表示为 ;
使反应变快的可能原因是
;从该反应器溶液(含有少量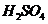 以抑制水解)中取得产品的试验操作步骤应为
、
、 ,取得产品后的残留物质可循环使用。
以抑制水解)中取得产品的试验操作步骤应为
、
、 ,取得产品后的残留物质可循环使用。
(2)可持续发展的原则要求化工生产①原理科学;②能量消耗低;③原料利用率高;④无污染。则在五组方案中,有科学性错误的是 组方案,有污染的是 组方案,无污染但能量消耗较高的是 组方案,因此选择 组方案最好。
II.另一化学兴趣小组从化学手册上查得硫酸铜500℃在以上按照下式分解:
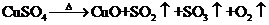 ,便决定设计试验测定反应生成的
,便决定设计试验测定反应生成的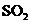 、
、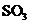 和
和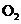 的物质的量,并经计算确定该条件下
的物质的量,并经计算确定该条件下 分解反应方程式中各物质的化学计量数。试验可能用到的仪器如下图所示:
分解反应方程式中各物质的化学计量数。试验可能用到的仪器如下图所示:
试验测得数据及有关结果如下;
①准确称取6.0g无水 ;②在试验结束时干燥管总质量增加2.4g;③测得量筒中水的体积,得出气体在标准状况下的体积为280.mL;试验结束时,装置F中的溶液只含NaHSO4和NaHSO3
;②在试验结束时干燥管总质量增加2.4g;③测得量筒中水的体积,得出气体在标准状况下的体积为280.mL;试验结束时,装置F中的溶液只含NaHSO4和NaHSO3
按装置从左到右的方向,各仪器接口连结顺序为:①⑨⑩⑥⑤③④⑧⑦②
试回答下列问题:
(1)装置F的作用是 。
(2)装置D的作用是 。
(3)为减少测量气体体积引起的误差,应注意的事项有:
①装置内气体的温度应恢复到室温。
② ,
③ 。
(4)通过计算,推断出该条件下反应的化学方程式
答案:1B 2C 3C
4.纯净的过氧化钙(CaO2)是白色的粉末,难溶于水,不溶于乙醇、乙醚,常温
下较为稳定,是一种新型水产养殖增氧剂,常用于鲜活水产品的运输。实验室可用钙盐制取CaO2·8H2O,再经脱水制得CaO2。CaO2·8H2O在0℃时稳定, 在室温时经过几天就分解,加热至130℃时逐渐变为无水CaO2。
其制备过程如下:

(1)用化学方程式表示出过氧化钙用做水产养殖增氧剂的原理:
。
(2)为了控制沉淀温度为0℃左右,在实验室宜采取的方法是 。
(3)该制法的副产品为 (填化学式),为了提高副产品的产率,结晶前要将
溶液的pH调整到合适范围,可加入下列试剂中的 (填写A或B)。
A.盐酸 B.氨水
(4)为了检验“水洗”是否合格,可取少量洗涤液于试管中,再滴加
进行检查。
(5)测定产品中CaO2的含量的实验步骤是:
第一步,准确称取ag产品于有塞锥形瓶中,加入适量蒸馏水和过量的bgKI晶体,再滴入少量2 mol·L-1的H2SO4溶液,充分反应。
第二步,向上述锥形瓶中加入几滴淀粉溶液。
第三步,逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液VmL。
(已知:I2+2S2O32-===2I-+S4O62-(无色))
①第三步中说明反应恰好完全的现象是 ;
②CaO2的质量分数为 (用字母表示)
3.下列说法不正确的是 ( )
①将CO2通入溶有足量氨的BaCl2溶液中,无白色沉淀生成
②将盐酸、KSCN溶液和Fe(NO3)2溶液三种溶液混合,混合溶液显红色
③向某溶液中滴入盐酸酸化的BaCl2溶液产生白色沉淀,证明溶液中一定含有SO42-
④将两小块质量相等的金属钠,一块直接投入水中,另一块用铝箔包住,在铝箔上刺些小孔,然后按入水中,两者放出的氢气质量相等
A.只有② B.①②③ C.①③④ D.①②③④
2.生活中常用到一些化学知识,下列分析中正确的是 ( )
A.医疗上可用硫酸钡作x射线透视肠胃的内服药,是因为硫酸钡不溶于水
B.某雨水样品放置一段时间后pH由4.68变为4.00,是因为水中溶解的CO2增多
C.氯气可用作消毒剂和漂白剂,是因为氯气与水反应生成的次氯酸具有强氧化性
D.加碘食盐中添加碘酸钾而不用碘化钾,是因为碘酸钾能溶于水而碘化钾不溶于水
1.下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是( )
①①向饱和碳酸钠溶液中通入过量的CO2;
②向Fe(OH)3胶体中逐滴加入过量的稀盐酸;
③向AgNO3溶液中逐滴加入过量氨水;
④向硅酸钠溶液中逐滴加入过量的盐酸
A.①② B.①④ C.①③ D.②③
17.海水是人类的资源宝库,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源。
I、海水淡化历史最悠久、技术最成熟的方法是 。
II、海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如下图:

(1)步骤①反应的离子方程式是 。
(2)步骤③反应的化学方程式是 。
(3)提取溴单质,采用蒸馏“溴水混合物II”而不是蒸馏“溴水混合物I”,请说明原因
。
III、(1)请写出电解食盐水制取氯气的化学方程式 。
(2)若电解2 L饱和食盐水,通过电路的电子的物质的量为2 mol ,则若用混合均匀后的pH为 ;若用该溶液将阳极产物全部吸收,反应是离子方程式为 ,所得溶液的pH 7(填“>”、“=”、“ <”),理由是 。
(3)已知常温下三种物质电离反应的平衡常数如下:H2CO3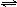 HCO3-+H+ K1=4.45×10-7,HCO3-
HCO3-+H+ K1=4.45×10-7,HCO3-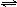 CO32-+H+ K2=5.16×10-11,,HClO
CO32-+H+ K2=5.16×10-11,,HClO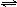 ClO-+ H+ K3=2.95×10-8,请写出氯气和碳酸钠物质的量之比为1∶1时,把氯气通入碳酸钠溶液中反应的离子方程式:
。
ClO-+ H+ K3=2.95×10-8,请写出氯气和碳酸钠物质的量之比为1∶1时,把氯气通入碳酸钠溶液中反应的离子方程式:
。
[答案]1 A
2 D 3 A 4 B
5 A 6D 7 B 8A
9 B 10 B 11C 12C
13:(1)CO2(SO2)、H2S、AlCl3中任选两种(2)Cl2 ;A中R的化合价必介于B、C之间。
14(1)①H-O-H ②2C+SiO2 Si+2CO↑ (各2分)
(2)2Na2O2+2CO2=Na2CO3+O2; 呼吸面具和潜水艇中做为氧气的来源
15 (1)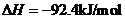
(2)①②
(3)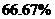 0.02
0.02
(4)①负极,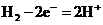 ; 阳极,
; 阳极,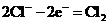
②13
16(1)0.008mol(2分); 268.8(2分);
(2)①A(1分),因为A装置可以通N2将装置中的空气排尽,防止NO被空气中O2氧化(2分) ②123547(2分)(注: 1547考虑也给分) ③升高(1分)
(3)有(2分) 因为NO2与水反应生成的NO的体积小于收集到的NO的体积(89.6<112.0)
17 I. 蒸馏法 (1分)
II.(1)2Br-+ Cl2=2Cl-+Br2 (2分) SO2+ Br2 +2H2O=2HBr +2H2SO4 (2分)
(3)“溴水混合物II”实际上是“溴水混合物I”的浓缩结果,蒸馏时生产成本低。(2分)

III. (1)2NaCl+2H2O 2NaOH+H2↑+Cl2↑ (1分)
(2)14(2分)Cl2+ 2OH-= ClO-+ Cl-+ H2O
(1分) > (1分)ClO-+ H2O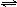 HClO+ OH-(1分)
HClO+ OH-(1分)
(3) Cl2+ CO32-+ H2O = HClO + Cl-+ HCO3- (2分)
[专题综合]
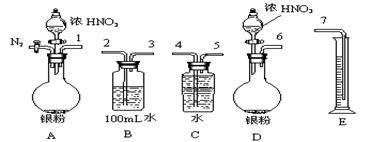
16. 某课外活动小组设计了以下实验方案验证Ag与浓硝酸反应的过程中可能产生NO。其实验流程图如下:



(1)测定硝酸的物质的量
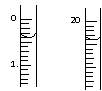
 反应结束后,从下图B装置中所得100mL溶液中取出25.00mL溶液,用0.1mol·L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置如上图所示。在B容器中生成硝酸的物质的量为
mol,则Ag与浓硝酸反应过程中生成的NO2体积为
mL。
反应结束后,从下图B装置中所得100mL溶液中取出25.00mL溶液,用0.1mol·L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置如上图所示。在B容器中生成硝酸的物质的量为
mol,则Ag与浓硝酸反应过程中生成的NO2体积为
mL。
(2)测定NO的体积
①从上图所示的装置中,你认为应选用 装置进行Ag与浓硝酸反应实验,选用的理由是 。
②选用上图所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是
(填各导管口编号)。
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置
(“下降”或“升高”),以保证量筒中的液面与集气瓶中的液面持平。
(3)气体成分分析
若实验测得NO的体积为112.0mL(已折算到标准状况),则Ag与浓硝酸反应的过
程中 (填“有”或“没有”)NO产生,作此判断的
依据是 。
1.x是中学化学中的常见物质,X既能与稀硫酸反应,又能与氢氧化钠溶液反应。
(1)若X为氧化物.X的化学式为_____________。
(2)若X为单质,X用于焊接钢轨时,发生反应的化学方程式为_____________。
(3)若X与稀硫酸反应生成无色无味的气体A,与浓氢氧化钠溶液加热反应生成气
体B。等物质的量的A和B在水溶液中反应又生成X。
常温下X与足量稀氢氧化钠溶液反应的离子方程式为_____________。
II.铜既能与稀硝酸反应.也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为: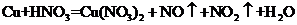 (未配平)
(未配平)
(1)硝酸在该反应中的作用是_____,该反应的还原产物是_____。
(2)0.3mol Cu被硝酸完全溶解后,Cu失去的电子数是_____,如果得到的N0和
NO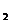 物质的量相同,则参加反应的硝酸的物质的量是_____,若用捧水法收集
物质的量相同,则参加反应的硝酸的物质的量是_____,若用捧水法收集
这些气体,可得标准状况下的气体体积_____。
(3)如果参加反应的Cu平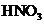 的物质的量之比是5:14,写出并配平该反应的离子
的物质的量之比是5:14,写出并配平该反应的离子
方程式________________________________________。
15.(山东省实验中学2009届高三第三次诊断)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com