
15.(09年广东理基·29)已知汽车尾气无害化处理反应为2NO(g)+2CO(g) N2(g)+2CO2(g)。下列说法不正确的是
N2(g)+2CO2(g)。下列说法不正确的是
A.升高温度可使该反应的逆反应速率降低
B.使用高效催化剂可有效提高正反应速率
C.反应达到平衡后,NO的反应速率保持恒定
D.单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡
答案:A
解析:升高温度、使用催化剂都会使化学反应速率升高,既包括正反应速率也包括逆反应速率,故A选项错误,B选项正确。反应达到平衡后,正反应速率和逆反应速率相等,因此C、D选项都是正确的。
 16
16 .(09年江苏化学·14)I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)
.(09年江苏化学·14)I2在KI溶液中存在下列平衡:I2(aq)+I-(aq) I3-(aq)
I3-(aq)
 某I2、、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是
某I2、、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是


A.  反应 I2(aq)+I-(aq)
反应 I2(aq)+I-(aq) I3-(aq)的△H>0
I3-(aq)的△H>0
 B.若温度为T1、T2,反应的平衡常数分别为K1、K2则K1>K2
B.若温度为T1、T2,反应的平衡常数分别为K1、K2则K1>K2
 C.若反应进行到状态D时,一定有v正>v逆
C.若反应进行到状态D时,一定有v正>v逆
 D.状态A与状态B相比,状态A的c(I2)大
D.状态A与状态B相比,状态A的c(I2)大
 答案:BC
答案:BC
 解析:随着温度的不断升高,I3-的浓度逐渐的减小,说明反应向逆方向移动,也就意味着该反应是放热反应,所以△H<0,所以A项错;因为K=
解析:随着温度的不断升高,I3-的浓度逐渐的减小,说明反应向逆方向移动,也就意味着该反应是放热反应,所以△H<0,所以A项错;因为K=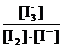 ,T2>T1,所以当温度升高时,反应向逆方向移动,即K1>K2;C项,从图中可以看出D点并没有达到平衡状态,所以它要向A点移动,这时I3-的浓度在增加,所以v正>v逆,C项正确;D项,从状态A到状态B,I3-的浓度在减小,那么I2的浓度就在增加。
,T2>T1,所以当温度升高时,反应向逆方向移动,即K1>K2;C项,从图中可以看出D点并没有达到平衡状态,所以它要向A点移动,这时I3-的浓度在增加,所以v正>v逆,C项正确;D项,从状态A到状态B,I3-的浓度在减小,那么I2的浓度就在增加。
 [考点分析](1)
[考点分析](1) 化学平衡的移动;(2)平衡常数的运用。
化学平衡的移动;(2)平衡常数的运用。
14.(09年广东化学·15)取5等份NO2 ,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:2NO2(g) N2O4(g),△H<0。反应相同时间后,分别测定体系中NO2的百分量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是
N2O4(g),△H<0。反应相同时间后,分别测定体系中NO2的百分量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是
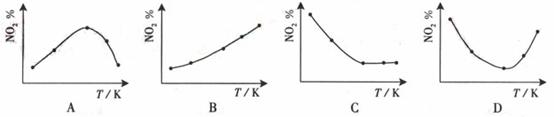
答案:BD
解析:在恒容状态下,在五个相同的容器中同时通入等量的NO2,反应相同时间。那么则有两种可能,一是已达到平衡状态,二是还没有达到平衡状态,仍然在向正反应移动。若5个容器在反应相同时间下,均已达到平衡,因为该反应是放热反应,温度越高,平衡向逆反应方向移动,NO2的百分含量随温度升高而升高,所以B正确。若5个容器中有未达到平衡状态的,那么温度越高,反应速率越大,会出现温度高的NO2转化得快,导致NO2的百分含量少的情况,在D图中转折点为平衡状态,转折点左则为未平衡状态,右则为平衡状态,D正确。
13.(09年广东化学·7)难挥发性二硫化钽(TaS2 )可采用如下装置提纯。将不纯的TaS2 粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中。反应如下:
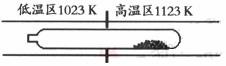 TaS2 (s)+2I2 (g)
TaS2 (s)+2I2 (g) 
 TaI4 (g)+S2 (g)
TaI4 (g)+S2 (g)
下列说法正确的是
A.在不同温度区域,TaI4 的量保持不变
B.在提纯过程中,I2 的量不断减少
C.在提纯过程中,I2 的作用是将TaS2 从高温区转移到低温区
D.该反应的平衡常数与TaI4 和S2 的浓度乘积成反比
答案:C
解析:高温区TaS2反应生成TaI4气体至低温区,从而在低温区重新生成TaS2,一段时间后,杂质留在高温区,TaS2在低温区,从而达到分离效果。不同温度下反应的方向不同,TaI4的量与温度高低有关并非保持不变,A错误;因为是在同一密闭系统中有质量守恒定律可知I2的量不可能不断减少,而是充当一个“搬运工”的角色,将TaS2从高温区转移到低温区,B错误,C正确。平衡常数与TaI4和S2的浓度乘积成正比,D错误。
12. (09年福建理综·12)某探究小组利用丙酮的溴代反应(CH3COCH3+Br2
(09年福建理综·12)某探究小组利用丙酮的溴代反应(CH3COCH3+Br2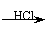
 CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率v(Br2)通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率v(Br2)通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
|
实验 序号 |
初始浓度c/mol·L-1 |
溴颜色消失 所需时间t/s |
||
|
CH3COCH3 |
HCl |
Br2 |
||
|
① |
0.80 |
0.20 |
0.0010 |
290 |
|
② |
1.60 |
0.20 |
0.0010 |
145 |
|
③ |
0.80 |
0.40 |
0.0010 |
145 |
|
④ |
0.80 |
0.20 |
0.0020 |
580 |

 分析实验数据所得出的结论不正确的是
分析实验数据所得出的结论不正确的是
 A.增大c(CH3COCH3), v(Br2)增大 B.实验②和③的v(Br2)相等
A.增大c(CH3COCH3), v(Br2)增大 B.实验②和③的v(Br2)相等
 C.增大c(HCl), v(Br2)增大 D.增大c(Br2),v(Br2)增大
C.增大c(HCl), v(Br2)增大 D.增大c(Br2),v(Br2)增大
答案:D
解析:从表中数据看,①④中CH3COCH3,HCl的浓度是相同的,而④中Br2比①中的大,所以结果,时间变长,即速率变慢了,D项错。其他选项依次找出表中两组相同的数据,看一变量对另一变量的影响即可。
10.(08年山东理综·14)高温下,某反应达到平衡,平衡常数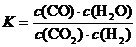 。恒容时,温度升高,H2浓度减小。下列说法正确的是A
。恒容时,温度升高,H2浓度减小。下列说法正确的是A
A.该反应的焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应的化学方程式为CO+H2O
 CO2+H2
CO2+H2
答案:A
解析:由平衡常数的表达式可得,该反应化学方程式应为CO2+H2
 CO+H2O,故D错;由题意知,温度升高,平衡向正反应移动,说明正反应为吸热反应,故该反应的焓变为正值,A正确;恒温恒容下,增大压强,H2浓度一定增大而不会减小,故B错;C项,升高温度,正逆反应速率都会 增大,故C错。
CO+H2O,故D错;由题意知,温度升高,平衡向正反应移动,说明正反应为吸热反应,故该反应的焓变为正值,A正确;恒温恒容下,增大压强,H2浓度一定增大而不会减小,故B错;C项,升高温度,正逆反应速率都会 增大,故C错。
11 .(09年安徽理综·11)汽车尾气净化中的一个反应如下:
.(09年安徽理综·11)汽车尾气净化中的一个反应如下: NO(g)+CO(g)
NO(g)+CO(g) N2(g)+CO2(g) △H=-373.4kJ·mol-1。
N2(g)+CO2(g) △H=-373.4kJ·mol-1。 在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是:
在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是:

 答案:C
答案:C
 解析:该反应为气体计量数减小的放热反应,升高温度,平衡逆向移动,生成物浓度减小,反应物浓度增大,平衡常数减小,A选项错误;同理,升高温度,平衡逆向移动,CO的转化率减小,B选项错误;平衡常数只与热效应有关,与物质的量无关,C选项正确;增加氮气的物质的量,平衡逆向移动,NO的转化率减小,D选项错误。
解析:该反应为气体计量数减小的放热反应,升高温度,平衡逆向移动,生成物浓度减小,反应物浓度增大,平衡常数减小,A选项错误;同理,升高温度,平衡逆向移动,CO的转化率减小,B选项错误;平衡常数只与热效应有关,与物质的量无关,C选项正确;增加氮气的物质的量,平衡逆向移动,NO的转化率减小,D选项错误。
9.(08年海南化学·10)X、Y、Z三种气体,取X和Y按1︰1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y 2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3︰2,则Y的转化率最接近于D
2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3︰2,则Y的转化率最接近于D
A.33% B.40% C.50% D.66%
答案:D
解析:由可知: X+2Y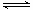 2Z
2Z
起始: 1 1 0
转化: a 2a 2a
平衡: 1-a 1-2a 2a
根据题意有: = ,a=,Y的转化率最接近65%。
8.(08年广东理基·36)对于反应2SO2(g)+O2(g) 2SO3(g)能增大正反应速率的措施是
2SO3(g)能增大正反应速率的措施是
A.通入大量O2 B.增大容器容积
C.移去部分SO3 D.降低体系温度
答案:A
解析:A. 通入大量O2,反应物浓度增大,正反应速率增大;
B. 增大容积,反应物、生成物浓度均减小,正、逆反应速率均下降;
C. 移去部分SO3会减小生成物浓度,刚开始正反应速率不变,而后下降;
D. 该反应为放热反应,但是降低体系温度正、逆反应速率均减小;同理若增大体
系问题,正、逆反应速率增大;
7.(08年广东化学·15)碘钨灯比白炽灯使用寿命长。灯管内封存的少量碘与使用过程中沉积在管壁上的钨可以发生反应:W(s)+I2(g)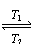
 WI2(g) ΔH<0(温度T1<T2)。下列说法正确的是AD
WI2(g) ΔH<0(温度T1<T2)。下列说法正确的是AD
A.灯管工作时,扩散到灯丝附近高温区的WI2(g)会分解出W1W重新沉积到灯丝上
B.灯丝附近温度越高,WI2(g)的转化率越低
C.该反应的平衡常数表达式是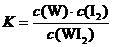
D.利用该反应原理可以提纯钨
答案:AD
解析:该反应的正反应为放热反应,温度升高,化学平衡向左移动。所以灯丝附近温度越高,WI2的转化率越高,B错。平衡常数,应为生成物除以反应物:
K=c(WI2)/c(W)·c(I2)利用该反应,可往钨矿石中,加如I2单质,使其反应生成WI2富集,再通过高温加热WI2生成钨,从而提纯W,D正确。
6.(08年广东化学·8)将H2(g)和Br2(g)充入恒容密闭容器,恒温下发生反应H2(g)+Br2(g)
 2HBr(g)△H<0,平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是A
2HBr(g)△H<0,平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是A
A.a>b B.a=b C.a<b D.无法确定
答案:A
解析:正反应为放热反应,前者恒温,后者相对前者,温度升高。使平衡向左移动,从而使Br2的转化率降低。所以b<a.
5.(08年宁夏理综·12)将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s) NH3(g)+HI(g);②2HI(g)
NH3(g)+HI(g);②2HI(g) H2(g)+I2(g)
H2(g)+I2(g)
达到平衡时,c(H2)=0.5mol·L-1,c(HI)=4mol·L-1,则此温度下反应①的平衡常数为
A.9 B.16 C.20 D.25
答案:C
解析:求①的平衡常数的关键是求氨气的平衡浓度,若碘化氢不分解时,NH3(g)和HI(g) 的平衡浓度是相等的,因此2c(H2) 与容器中平衡浓度c(HI)之和即为氨气的平衡浓度5 mol·L-1,故此温度下反应①的平衡常数为20。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com