
27. (07年山东理综·28)(11分)二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
(07年山东理综·28)(11分)二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
(1)硫酸生产中,SO2催化氧化生成SO3:
2SO2(g)+O2(g)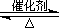 2SO3(g)
2SO3(g)
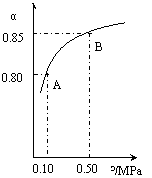
某温度下,SO2的平衡转化率(a)与体系总压强(p)的关系如右图所示。根据图示回答下列问题:
①将2.0mol SO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa。该反应的平衡常数等于_____。
②平衡状态由A变到B时.平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
 若用标准状况下4.48L CH4还原NO2至N2整个过程中转移的电子总数为______(阿伏加德罗常数的值用NA表示),放出的热量为______kJ。
若用标准状况下4.48L CH4还原NO2至N2整个过程中转移的电子总数为______(阿伏加德罗常数的值用NA表示),放出的热量为______kJ。
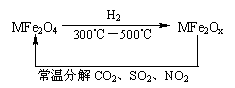
(3)新型纳米材料氧缺位铁酸盐(MFe2Ox 3<x<4,M=Mn、Co、Zn或Ni=由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
请写出MFe2Ox分解SO2的化学方程式 (不必配平)。
答案:(1)①800L·mol-1 ②= (2)1.60NA(或1.6NA) 173.4 (3)MFe2Ox+SO2→MFe2O4+S
解析:(1)据题意当容器中总压强为0.10MPa时,SO2的平衡转化率为0.80,据此可计算得出平衡时c(SO2)=0.040mol·L-1;c(O2)=0.020mol·L-1;c(SO3)=0.16mol·L-1。根据平衡常数的计算式:K= =800L·mol-1;只要温度不变,平衡常数就不改变,在此变化过程中,只有压强的改变,温度未发生变化,故K(A)=K(B)。
=800L·mol-1;只要温度不变,平衡常数就不改变,在此变化过程中,只有压强的改变,温度未发生变化,故K(A)=K(B)。
(2)用标准状况下4.48LCH4还原NO2 至N2,4.48LCH4的物质的量为0.20mol,在此过程中CH4中碳元素的化合价有-4价升高到+4价,转化为CO2,失去电子的总物质的量为0.20mol×8= 1.60mol,故转移电子数为1.60NA。由题目给知的热化学方程式,根据盖斯定律可以得出CH4还原NO2至N2的热化学方程式为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ·mol-1,则0.2molCH4反应放出的热量为867 kJ·mol-1×0.2mol=173.4kJ。
(3)此题中反应物已知为MFe2OX和SO2,反应后生成MFe2O4,由MFe2OX转化为MFe2O4,氧原子数增加,故SO2失去氧原子转化为S,反应式为:MFe2OX+SO2=MFe2O4+S。
26.(9分)(2007海南·17)下表是稀硫酸与某金属反应的实验数据:
|
实验序号 |
金属 质量/g |
金属状态 |
C(H2SO4) /mol·L-1 |
V(H2SO4) /mL |
溶液温度/℃ |
金属消失的时间/s |
|
|
反应前 |
反应后 |
||||||
|
1 |
0.10 |
丝 |
0.5 |
50 |
20 |
34 |
500 |
|
2 |
0.10 |
粉末 |
0.5 |
50 |
20 |
35 |
50 |
|
3 |
0.10 |
丝 |
0.7 |
50 |
20 |
36 |
250 |
|
4 |
0.10 |
丝 |
0.8 |
50 |
20 |
35 |
200 |
|
5 |
0.10 |
粉末 |
0.8 |
50 |
20 |
36 |
25 |
|
6 |
0.10 |
丝 |
1.0 |
50 |
20 |
35 |
125 |
|
7 |
0.10 |
丝 |
1.0 |
50 |
35 |
50 |
50 |
|
8 |
0.10 |
丝 |
1.1 |
50 |
20 |
34 |
100 |
|
9 |
0.10 |
丝 |
1.1 |
50 |
20 |
44 |
40 |
分析上述数据,回答下列问题:
(1)实验4和5表明, 对反应速率有影响, 反应速率越快,能表明同一规律的实验还有 (填实验序号);
(2)仅表明反应物浓度对反应速率产生影响的实验有 (填实验序号);
(3)本实验中影响反应速率的其他因素还有 ,其实验序号是 。
(4)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因: 。
答案:(1)固体反应物的表面积 表面积越大 1和2
(2)3和4(3)开始反应温度 6和7
(4)一定量的金属跟足量的硫酸反应放出的热量相同
考点:本题考查了通过处理实验数据研究化学反应速率的影响因素。
解析:比较表中实验1和2、实验4和5,其他条件都一样,只是金属状态由丝变成了粉末,金属消失的时间就少了很多,反应速率变快很多,也就是说明金属固体的表面积越大,速率就越快。同理,比较表中各项数据进行分析不难得出正确答案。
25.(6分)(2007海南·16)PCl5的热分解反应如下:
PCl5(g) PCl3(g) + Cl2(g)
PCl3(g) + Cl2(g)
(1) 写出反应的平衡常数表达式;
(2) 已知某温度下,在容积为10.0L的密闭容器中充入2.00mol PCl5,达到平衡后,测得容器内PCl3的浓度为0.150mol/L。计算该温度下的平衡常数。
答案:(1)K==
(2)
PCl5(g) PCl3(g)
+ Cl2(g)
PCl3(g)
+ Cl2(g)
c(起始)(mol/L) =0.200 0 0
c(变化)(mol/L) 0.150 0.150 0.150
c(平衡)(mol/L) 0.050 0.150 0.150
所以平衡常数K====0.45
考点:本题考查了化学平衡常数的求算。
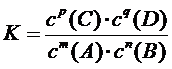 解析:对于反应: mA + nB
解析:对于反应: mA + nB  pC
+ qD
1、定义: 在一定温度时,当一个可逆反应达到平衡状态时,生成物平衡浓度的幂之积与反应物平衡浓度的幂之积的比值是一个常数,这个常数称为化学平衡常数简称平衡常数。
2.数学表达式:
平衡常数的数学表达式
pC
+ qD
1、定义: 在一定温度时,当一个可逆反应达到平衡状态时,生成物平衡浓度的幂之积与反应物平衡浓度的幂之积的比值是一个常数,这个常数称为化学平衡常数简称平衡常数。
2.数学表达式:
平衡常数的数学表达式
24.(07年广东化学·25)(10分)
黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4。
(1)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应:2SO2(g)+O2(g)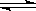 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol·L-3。计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程)。
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol·L-3。计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程)。
(2)已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的有 (填字母)
A.升高温度
B.降低温度
C.增大压强
D.减小压强
E.加入催化剂
G.移出氧气
(3)SO2尾气用饱和Na2SO3溶液吸收可得到更要的化工原料,反应的化学方程式为 。
(4)将黄铁矿的煅烧产物Fe3O4溶于H2SO4后,加入铁粉,可制备FeSO4。酸溶过程中需保持溶液足够酸性,其原因是 。
答案:(10分)
(1)1.6×103L/mol 80%(计算过程略)
(2)B、C
(3)SO2+H2O+Na2SO3=2NaHSO3
(4)抑制Fe2+、Fe3+的水解,防止Fe2+被氧化成Fe3+
解析:难度,易。此题是比较中规中矩考查化学平衡知识的题目,题目条件比较直接,学生完成得应比较愉快。
23.(07年广东化学·22)(8分)
“碘钟”实验中,3I-+S2O42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到的数据如下表:
|
实验编号 |
① |
② |
③ |
④ |
⑤ |
|
c(I-)/mol·L- |
0.040 |
0.080 |
0.080 |
0.160 |
0.120 |
|
c(SO42-)/mol·L- |
0.040 |
0.040 |
0.080 |
0.020 |
0.040 |
|
t /s |
88.0 |
44.0 |
22.0 |
44.0 |
t2 |
回答下列问题:
(1)该实验的目的是 。
(2)显色时间t2= 。
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为 (填字母)
A.<22.0s
B.22.0-44.0s
C.>44.0s
D.数据不足,无法判断
答案:(8分)
(1)研究反应物I-与S2O82-的浓度对反应速率的影响
(2)29.3s
(3)A
(4)反应速率与反应物起始浓度乘积成正比(或显色时间与反应物起始浓度乘积成反比)
解析:难度,易。本题考查学生对影响化学反应速率的外界因素如浓度、温度及其规律的认识和理解,考查学生对图表的观察、分析以及处理实验数据归纳得出合理结论的能力。由题目中表格数据可分析出c(I-)、 c(S2O32-)浓度越大,反应速率越快,显蓝色所需时间越少,故实验目的应是研究反应物I-与S2O82-的浓度对反应速率的影响,因反应速率与反应物起始浓度乘积成正比(或显色时间与反应物起始浓度乘积成反比),由①⑤中数据可列关系:显色时间t2=0.040·0.040·88.0/0.120·0.040=29.3 s,升高温度,反应速率加快,故显色时间t2<22.0s。07年广东高考在选择题方面减弱了考查,只有第18题的选项C、D中提到。在第二卷中也一改前二年的化学平衡图象题,改为化学反应速率的表格分析题,实际要求仍是考查学生运用所学化学反应速率与化学平衡思想解决指定问题的能力。
22.(09年海南化学·4) 在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
|
物质 |
X |
Y |
Z |
|
初始浓度/mol·L-1 |
0.1 |
0.2 |
0 |
|
平衡浓度/mol·L-1 |
0.05 |
0.05 |
0.1 |

 下列说法错误的是:
下列说法错误的是:


 A.反应达到平衡时,X的转化率为50%
A.反应达到平衡时,X的转化率为50%
 B.反应可表示为X+3Y
B.反应可表示为X+3Y 2Z,其平衡常数为1600
2Z,其平衡常数为1600
 C.增大压强使平衡向生成Z的方向移动,平衡常数增大
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
 D.改变温度可以改变此反应的平衡常数
D.改变温度可以改变此反应的平衡常数
答案:C
解析:题中有一明显的错误,就是C选项中平衡常数增大,增大压强不可能使平衡常数增大。其他选项均为平衡中的基础计算和基础知识,关键是根据表中数据(0.1-0.05)∶(0.2-0.05)∶(0.1-0)=1∶3∶2可推导出:X+3Y 2Z。
2Z。
21.(09年广东文基·68)下列说法正确的是
A.废旧电池应集中回收,并填埋处理
B.充电电池放电时,电能转变为化学能
C.放在冰箱中的食品保质期较长,这与温度对反应速率的影响有关
D.所有燃烧反应都是放热反应,所以不需吸收能量就可以进行
答案:C
解析:A项废旧电池应集中回收但不能填埋处理因为电池里的重金属会污染土地,人吃了这些土地里的蔬菜后,,就会引发疾病;B项充电电池放电时,化学能转变为电能;D项有的燃烧反应是需要吸收一定热量才可以反应的比如碳的燃烧。
[考点分析]垃圾的处理、电化学、影响化学反应速率因素、化学反应与能量。
19.(09年山东理综·14)2SO2(g)+O2(g)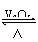
 2SO3(g)是制备硫酸的重要反应。下列叙述正确的是
2SO3(g)是制备硫酸的重要反应。下列叙述正确的是
A.催化剂V2O5不改变该反应的逆反应速率
B.增大反应体系的压强、反应速度一定增大
C.该反应是放热反应,降低温度将缩短反应达到平衡的时间
D.在t1、t2时刻,SO3(g)的浓度分别是c1,c2,则时间间隔t1-t2内,SO3(g)生成的平均速率为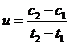

答案:D
解析:催化剂可以同等程度的改变正逆反应的反应速率;如果是通入惰性气体增大了体系压强,反应物浓度未变,反应速率不变;降温,反应速率减慢,达到平衡的时间增大;D是反应速率的定义,正确。
20 .(09年天津理综·5)人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力,CO吸入肺中发生反应:CO+HbO2
.(09年天津理综·5)人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力,CO吸入肺中发生反应:CO+HbO2 O2+HbCO,37 ℃时,该反应的平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是
O2+HbCO,37 ℃时,该反应的平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是
 A.CO与HbO2反应的平衡常数K=
A.CO与HbO2反应的平衡常数K=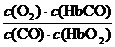
 B.人体吸入的CO越多,与血红蛋白结合的O2越少
B.人体吸入的CO越多,与血红蛋白结合的O2越少
 C.当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损
C.当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损
 D.把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动
D.把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动
 答案:C
答案:C
解析:由反应方程式知,K的表达式正确,A对;CO与HbO2反应的平衡常数达220,可见其正向进行的程度很大,正确。K=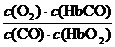 ,由题意知,K=220,
,由题意知,K=220,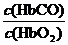 =0.02时,人受损,则c(CO)/c(O2)=9×10-5,C项错。D项,当O2浓度很大时,题中平衡将逆向移动,从而解救人,正确。
=0.02时,人受损,则c(CO)/c(O2)=9×10-5,C项错。D项,当O2浓度很大时,题中平衡将逆向移动,从而解救人,正确。
18.(09年宁夏理综·13)在一定温度下,反应H2(g)+X2(g) HX(g)的平衡常数为10。若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于
HX(g)的平衡常数为10。若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于
A.5% B.17% C.25% D.33%
答案:B
解析:1/2H2(g)+ 1/2X2(g)  HX(g)的平衡常数K1为10,那么HX(g)
HX(g)的平衡常数K1为10,那么HX(g)  1/2H2(g)+
1/2X2(g) 的平衡常数K2为1/10,
2HX(g)
1/2H2(g)+
1/2X2(g) 的平衡常数K2为1/10,
2HX(g)  H2(g)+
X2(g) 的平衡常数K3为(1/10)2=0.01.设HX(g)分解xmol/L,有,
2HX(g)
H2(g)+
X2(g) 的平衡常数K3为(1/10)2=0.01.设HX(g)分解xmol/L,有,
2HX(g)  H2(g)+
X2(g)
H2(g)+
X2(g)
1 0 0
x x x
1-x x x
K3= x·x/(1-x) 2= 0.01 ,得到x=0.17,所以, 该温度时HX(g)的最大分解率接近于B. 17%
[点评]本题考查化学平衡常数的相关计算,题目难度不大,但要求考生平时要掌握方程式的变化对于化学平衡常数表达式的影响和数值的改变。
17.(09年宁夏理综·10)硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的是
|
实验 |
反应温度/℃ |
Na2S2O3溶液 |
稀H2SO4 |
H2O |
||
|
V/mL |
c/mol·L-1 |
V/mL |
c/mol·L-1 |
V/mL |
||
|
A |
25 |
5 |
0.1 |
10 |
0.1 |
5 |
|
B |
25 |
5 |
0.2 |
5 |
0.2 |
10 |
|
C |
35 |
5 |
0.1 |
10 |
0.1 |
5 |
|
D |
35 |
5 |
0.2 |
5 |
0.2 |
10 |
答案:D
解析:影响化学反应速率的因素众多,本题从浓度和和温度两个因素考查,非常忠实于新教材必修2,只要抓住浓度越大,温度越高反应速率越大,便可以选出正确答案D。
[点评]本题主要考查影响化学反应速率的因素,题目来源于课本,考生很有亲切感。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com