
1、 可逆反应:在同一条件下,既可以想正反应方向进行,同时又可以想逆反应方向进行。可逆反应有一定限度,反应物不可能完全转化为生成物。
例如:Cl2+H2O 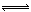 HCl+HClO 2Fe3++2I-
HCl+HClO 2Fe3++2I- 2Fe2++I2
2Fe2++I2
2.影响化学反应速率的因素
(1)内因:反应物的性质(主要)
(2)外因 其他条件不变时
①温度:温度越高反应速率越快)
②压强:对于有气体参加的反应,增加压强化学反应速率越快
③浓度:浓度越大反应速率越快
④催化剂:使用正催化剂化学反应速率增大
其他:反应接触面积的大小、固体反应物的颗粒大小、光照、超声波、电磁波、溶剂等对反应速率也有影响。
等因素对反应速率也有影响
1.
定义:化学反应速率是用来衡量化学反应进行 快慢 的物理量, 常用单位时间内反应物浓度的减小或生成物浓度的增加来表示,其数学表达式可表示为 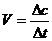 单位 moL/(L·s)
单位 moL/(L·s)
注意:各物质表示的速率比等于该反应方程式中相应的计量系数比
9、同分异构体:分子式相同结构式不同的化合物互称
 C4H10 CH3CH2CH2CH3 CH3CHCH3 异丁烷
C4H10 CH3CH2CH2CH3 CH3CHCH3 异丁烷
正丁烷 CH3 CH3


 C5H12 CH3CH2CH2
CH2 CH3 CH3CHCH2
CH2 CH3C CH3
C5H12 CH3CH2CH2
CH2 CH3 CH3CHCH2
CH2 CH3C CH3
戊烷 CH3 CH3
2-甲基丁烷 2,2-二甲基丙烷
专题六 化学反应与能量
第一单元 反应速率与反应限度
8、碳最外层四个电子,一个碳原子可以形成四个共价键,可以构成C-C、C=C、C≡C
7、电子式
(1)写出下列物质的电子式:H2 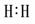 Cl2
Cl2 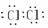 N2
N2 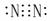 HCl
HCl 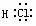 H2O
H2O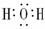 CO2
CO2 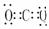 NH3
NH3 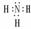 CH4
CH4 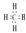 NaCl
NaCl
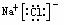 MgCl2
MgCl2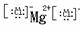 NaOH Na+
NaOH Na+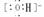
用电子式表示下列物质的形成过程:
(1) HCl : (2)NaCl:
6、化学键:物质中直接相邻的原子或离子之间强烈的相互作用
|
离子化合物:阴、阳离子通过静电作用相成的化合物
离子键:活泼的金属 活泼的非金属
(2) 共价键:原子之间通过共用电子对所形成的强烈的相互作用
共价化合物:通过共用电子对所形成的化合物
非极性键:相同的非金属元素之间 极性键 不同的非金属元素之间
5、 元素周期表 短周期 1、2、3
元素周期表 短周期 1、2、3
 周期 长周期4、5、6
周期 长周期4、5、6
(1)结构 不完全周期7
 主族 ⅠA-ⅦA
主族 ⅠA-ⅦA
族 副族ⅠB-ⅦB
第Ⅷ族 8、9、10 0族 惰性气体
(2)周期序数 = 电子层数 主族序数 = 原子最外层电子数
(3)每一周期从左向右,原子半径逐渐 减小;主要化合价从 +1- +7(F、O无正价),金属性逐渐减弱,非金属性逐渐增强。
每一主族从上到下右,原子半径逐渐增大 ;金属性逐渐增强 ,非金属性逐渐减弱。
4、元素周期律:元素的性质随着原子核电荷数的递增而呈现周期性变化的规律
元素周期律是元素核外电子排布随元素核电荷数的递增的必然结果
(1) 随着原子核电荷数的递增原子的最外层电子电子排布呈现周期性变化
除1、2号元素外,最外层电子层上的电子重复出现1递增8的变化
(2)随着原子核电荷数的递增原子半径呈现周期性变化
同周期元素,从左到右,原子半径 减小 ,如:Na Mg Al Si P S Cl;C N O F
(3)随着原子核电荷数的递增元素的主要化合价呈现周期性变化
同周期最高正化合价从左到右逐渐增加,最低负价的绝对值逐渐减小
元素的最高正化合价==原子的 最外层电子数 ;最高正化合价与负化合价的绝对值之和= 8 。
(4)随着原子核电荷数的递增元素的金属性和非金属性呈现周期性变化
同周期,从左到右 元素的金属性逐渐减弱,元素的非金属性逐渐增强
Na Mg Al Si P S Cl 金属性:Na>Mg>Al
金属性逐渐减弱 非金属性逐渐增强
非金属性:Cl>S>P>Si,
非金属性逐渐增强
非金属性:Cl>S>P>Si,
(5)①元素的金属性越强,最高价氧化物对应的水化物(氢氧化物)碱性越 强,反之也如此。金属性:Na>Mg>Al,氢氧化物碱性强弱为NaOH > Mg(OH)2> Al(OH)3。
②元素的非金属性越强,最高价氧化物对应的水化物(含氧酸)酸性越 强 ,反之也如此。
非金属性:Si <P< S< Cl,H3PO4是 弱 酸,H2SO4是 强 酸, HClO4是最强酸;H3PO4 <H2SO4< HClO4;元素的非金属性越强,形成的氢化物越 稳定;氢化物的稳定性为SiH4<PH3<H2S<HCl
3、1-18号元素的原子结构示意图 P书2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com