
2.(2010年天津卷)20世纪50年代,毛泽东为探索社会主义建设道路所发表的主要著作有
①《论十大关系》 ②《论人民民主专政》
③《新民主主义论》 ④《关于正确处理人民内部矛盾的问题》
A.①② B.①④ C.②③ D.②④
[解析]B 此题可用排除法做。②《论人民民主专政》发表于1949年6月30日,是毛泽东为纪念中国共产党成立28周年而写的一篇论文。它的发表为新中国的成立作了理论、路线、方针的准备,故不符合题中所给的时间限定:“20世纪50年代”,可排除,而选项A、C、D 都包含了② ,所以可得出本题答案为 B。
说明:本资料精选全国各地高考真题和全国新课标地区名校月考、联考、大市模拟试题,对备战2011年高考具有较好的指导作用。
1.(2010年上海历史卷)1978年关于真理标准问题的大讨论,直接推动了中国社会全面的
A.体制改革 B.拨乱反正 C.经济建设 D. 对外开放
[解析]B 1978年关于真理标准问题的讨论,打破了个人崇拜和教条主义的精神枷锁,对于党的指导思想和实际工作的拨乱反正,产生巨大影响。
21.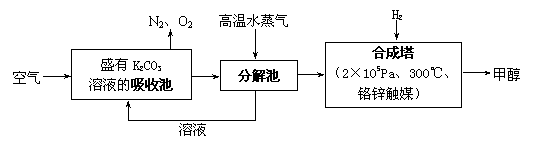 (7分)甲醇是可再生燃料,可以利用天然气等物质生产,生产成本低,用途广泛。最近有科学家提出:把含有0.050%CO2的空气(通常情况下空气中CO2的体积分数为0.030%,当空气中CO2的体积分数超过0.050%时,会引起明显的温室效应。)吹入碳酸钾溶液中,然后再想法把CO2从溶液中提取出来,经化学反应后得到甲醇,其构想技术流程如下:
(7分)甲醇是可再生燃料,可以利用天然气等物质生产,生产成本低,用途广泛。最近有科学家提出:把含有0.050%CO2的空气(通常情况下空气中CO2的体积分数为0.030%,当空气中CO2的体积分数超过0.050%时,会引起明显的温室效应。)吹入碳酸钾溶液中,然后再想法把CO2从溶液中提取出来,经化学反应后得到甲醇,其构想技术流程如下:
试回答下列问题:
(1)写出吸收池中主要反应的离子方程式:
____________________ __ _。
(2)写出合成塔中反应的化学方程式:
_________________ _ __。
(3)若吹入的空气体积为33.6m3(标准状况下),则理论上最多可生产 g甲醇
20.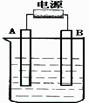 (7分)在如下图用石墨作电极的电解池中,放入500mL硫酸铜溶液进行电解,当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g。请回答下列问题:
(7分)在如下图用石墨作电极的电解池中,放入500mL硫酸铜溶液进行电解,当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g。请回答下列问题:
(1)A接的是电源的 极,B是该装置的 极。
(2)写出电解时B极的电极反应式式
(3)写出电解时反应的总离子方程式 。
若电解后溶液的体积仍为500mL,该溶液的PH为
18.(15分)硫酸铵是一种常用的铵态氮肥。下表是硫酸铵化肥品质的主要指标。
|
项目 |
指 标 |
||
|
优等品 |
一等品 |
合格品 |
|
|
外观 |
白色结晶,无可见机械杂质 |
无可见机械杂质 |
|
|
氮(N)含量 |
≥21.0﹪ |
≥21.0﹪ |
≥20.5﹪ |
 新华中学化学研究性学习小组为本地农业生产服务,对某农用品商店出售的一等品硫酸铵化肥的品质进行探究。
新华中学化学研究性学习小组为本地农业生产服务,对某农用品商店出售的一等品硫酸铵化肥的品质进行探究。
[观察外观]该硫酸铵化肥无可见机械杂质。
[实验探究]按右图所示装置进行实验。
(1)①盛放浓氢氧化钠溶液的仪器名称是
②烧瓶内发生反应的离子方程式为:
______ __________
③烧杯中最适宜盛放的试剂是__________
A.浓硫酸 B.稀硫酸
C.盐酸 D.氨水
④B装置中为何不将导管直接插入试剂中
(2)实验过程中,需往烧瓶中加入足量浓氢氧化钠溶液并充分加热的原因是
_____________________________
[交流讨论]甲同学:根据此实验测得的数据,计算硫酸铵化肥的氮含量可能偏高,因为实验装置A和B间存在一个明显缺陷是:________________________ 乙同学:根据甲同学改进后计算硫酸铵化肥的氮含量又可能偏低,因为实验装置中还存在另一个明显缺陷是:____________________________
经过大家充分讨论一致认为:针对甲、乙两位同学指出的实验装置中存在的明显缺陷,需改进实验装置,重新进行实验。
[探究结论] 称取13.5g硫酸铵化肥样品,用改进后的实验装置重新进行实验,测得实验前后B装置增重3.40g。该化肥______ ___(填“是”或“不是”)一等品。
|
(1)氢元素与Z形成原子个数比为1∶1的化合物,其电子式为_____________。该化合物分子中存在__________(填“共价键”或“离子键”)。
(2)Y最高价氧化物的水化物与Y的氢化物恰好完全反应时,生成物的水溶液呈酸性,其原因是_________________________________________;(用离子方程式表示)
该溶液中各种离子浓度由大到小顺序为______________________________。
(3)①恒温下,在容积为2L的刚性容器中充入2mol H2与2mol Y的单质,5分钟后反应达到平衡时,此时Y的单质为1.8mol,则产物的反应速率为
平衡时容器内压强与反应前压强比为_______ ___;
②若该反应在恒温恒压条件下进行(其它条件相同),反应达到平衡时,H2的转化率比上述条件下H2的转化率_______(填“大”、“小”或“相同”)。
(4)常温下,由X的最简单气态氢化物3.2g在氧气中完全燃烧后恢复至常温,放出a kJ 的热量,试写出该反应的热化学方程式:____________________________________。
17.(7分)A、B、C、D均为中学化学常见的物质。它们之间存在如下图所示的转化关系时。
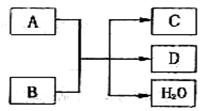
(1)若A为Cl2,B为Ca(OH)2,常温下反应的化学方程式为:
______________ ________________________
该反应的还原剂是
若有1molCl2参加反应,则反应中转移的电子数为
(2)若A为单质,C、D均为能使澄清石灰水变浑浊的无色气体,B的化学式为 。
16.(4分)在常温下,有下列九种物质:
①石墨 H2S ③CaCO3 ④液态NH3
⑤CH3COONH4 晶体 ⑥CO2 ⑦Na Cl溶液 ⑧Na
⑨CH3CH2OH
请根据要求填写下列空白:(填序号)
(1)属于非电解质的是 ;
(2)属于强电解质的是 ;
(3)在上述九种物质中,能导电的是 ;
(4)写出下列物质的电离方程式:H2S
15.单斜硫和正交硫是硫的两种同素异形体。
已知:①S(s,单斜) + O2(g)=== SO2 (g);△H1=-297.16kJ·mol-1
②S(s,正交) + O2(g) === SO2 (g);△H2=-296.83kJ·mol-1下列说法正确的是 ( )
A.S(s,单斜)===S(s,正交) ;△H3 = -0.33kJ·mol-1
B.单斜硫比正交硫稳定
C.相同物质的量的正交硫比单斜硫所含有的能量高
D.②式表示断裂lmol O2中的共价键所吸收的能量比形成1mol SO2中的共价键所放出的能量多296.83kJ
第Ⅱ卷(非选择题共55分)
14.将两个铂电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。已知。通入CH4的一极,其电极反应式是:CH4 + 10OH――8e-===CO32-+7 H2O;通入O2的另一极,其电极反应式是:2O2 + 4H2O + 8e-=== 8OH-下列叙述正确的是 ( )
A.通入CH4的电极为正极
B.该电池使用一段时间后无需补充KOH
C.燃料电池工作时,溶液中的OH-向正极移动
D.负极发生氧化反应
13.下列各组离子因发生氧化还原反应而不能大量共存的是 ( )
A.Ba2+、Cl-、SO32- B.NH4+、Al3+、OH-
C.Na+、H+、CO32- D.I-、H+、Fe3+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com