
直线方程考察的重点是直线方程的特征值(主要是直线的斜率、截距)有关问题,可与三角知识联系;圆的方程,从轨迹角度讲,可以成为解答题,尤其是参数问题,在对参数的讨论中确定圆的方程。
预测2011年对本讲的考察是:
(1)2道选择或填空,解答题多与其他知识联合考察,本讲对于数形结合思想的考察也会是一个出题方向;
(2)热点问题是直线的倾斜角和斜率、直线的几种方程形式和求圆的方程
2.圆与方程
回顾确定圆的几何要素,在平面直角坐标系中,探索并掌握圆的标准方程与一般方程。
1.直线与方程
(1)在平面直角坐标系中,结合具体图形,探索确定直线位置的几何要素;
( 2)理解直线的倾斜角和斜率的概念,经历用代数方法刻画直线斜率的过程,掌握过两点的直线斜率的计算公式;
2)理解直线的倾斜角和斜率的概念,经历用代数方法刻画直线斜率的过程,掌握过两点的直线斜率的计算公式;
(3)根据确定直线位置的几何要素,探索并掌握直线方程的几种形式(点斜式、两点式及一般式),体会斜截式与一次函数的关系;
16.(2010·漳州模拟)某研究性学习小组在用CO还原Fe2O3的实验中,用磁铁吸出生成的黑色粉末X,他们认为X不一定是Fe,若温度不同、受热不均时会生成Fe3O4,也能被磁铁吸引。为探究X的组成,他们进行了如下实验。
I.定性检验
|
实验编号 |
实验操作 |
实验现象 |
|
① |
取少量黑色粉末X放入试管1中,注入浓盐酸,微热 |
黑色粉末逐渐溶解,溶液呈黄绿色;有少量气泡产生 |
|
② |
向试管1中滴加几滴KSCN溶液,振荡 |
溶液出现血红色 |
|
③ |
另取少量黑色粉末X放入试管2中,注入足量硫酸铜溶液,振荡,静置 |
有极少量红色物质析出,仍有较多黑色固体未溶解 |
(1)实验②的目的是
(2)由上述实验现象推断,黑色粉末X的成分是 (填化学式)。
II.定量测定

(1)操作Z的名称是 。下列仪器中,在灼烧沉淀时必须用到的是
(填名称)

(2)写出溶液Y中滴加H2O2溶液时发生反应的离子方程式:
。
(3)通过以上数据,得出2.376 g黑色粉末X中各成分的物质的量为:
____________________________________________________________
[答案]
I.定性检验
(1)检验是否存在Fe3+ ,确认Fe3O4的存在。
(2)Fe3O4和Fe的混合物
II.定量测定
(1) 过滤、洗涤(干燥)。 坩埚、泥三角(填名称)。
(2)2Fe2+ + 2H+ + H2O2 = 2Fe3+ + 2H2O
(3)n(Fe3O4)=0.01mol;n(Fe)=0.001mol
()
15.(2010·大连模拟)某化学实验小组将适量浓硝酸分多次滴加到足量铜粉、足量稀硫酸的混合物中,加热使之反应完全,通过过滤、蒸发、结晶来制得硫酸铜晶体(装置如图1、2所示)。
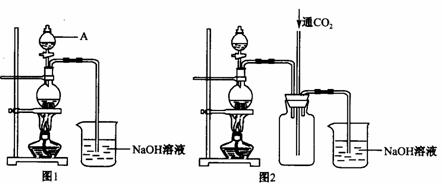

(1)写出圆底烧瓶中开始阶段发生反应的化学方程式 。
(2)把浓硝酸分多次加入到铜粉与稀硫酸的混合物中的目的是 。
(3)图2是图1的改进装置,其优点有
[答案]
(1)3Cu+2HNO3+3H2SO4=3CuSO4+2NO↑+4H2O 2NO+O2=2NO2
(2)确保所有的硝酸都作氧化剂,在溶液中将铜氧化,以生成硫酸铜
(3)防止倒吸,使氮氧化合物都被吸收掉
14.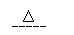 (2010·济南模拟)实验室中需要22.4 L(标准状况)SO2气体。化学小组同学依据化学方程式Zn+
(2010·济南模拟)实验室中需要22.4 L(标准状况)SO2气体。化学小组同学依据化学方程式Zn+
2H2SO4(浓) ZnSO4+SO2↑+2H2O计算后,取65.0g锌粒与98%的浓H2SO4( )110mL充分反应锌全部溶解,对于制得的气体,有同学认为可能混有杂质。
)110mL充分反应锌全部溶解,对于制得的气体,有同学认为可能混有杂质。
(1)化学小组所制得的气体中混有的主要杂质气体可能是 (填分子式)。产生这种结果
的主要原因是 (用化学方程式和必要的文字加以说明)
(2)为证实相关分析,化学小组的同学设计了实验,组装了如下装置,对所制取的气体进行探究。
①装置B中加入的试剂 ,作用是 。
②装置D加入的试剂 ,装置F加入的试剂 。
③可证实一定量的锌粒和一定量的浓硫酸反应后生成的气体中混有某杂质气体的实验现象是 。
④U型管G的作用为 .
[答案]
(1)H2 随着反应的进行,硫酸浓度降低,致使锌与稀硫酸反应生成H2
Zn+H2SO4====ZnSO4+H2↑
(2)①NaOH溶液(或KMnO4,其它合理答案也给分)
除去混合气体中的SO2。
②浓硫酸(1分) 无水硫酸铜
③装置E中玻璃管中黑色CuO粉末变红色,干燥管F中无水硫酸铜变蓝色
④防止空气中H2O进入干燥管而影响杂质气体的检验
13.(2010·广州模拟)铁在冷的浓硫酸中能发生钝化。某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。实验室现有下列试剂: 0.01 mol/L 酸性KMnO4溶液、0.1 mol/L KI溶液、3%H2O2溶液、淀粉溶液、蒸馏水。请你协助他们探究所得溶液和气体的成分。
[提出猜想]
Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种;
Ⅱ.所得气体中可能含有 中的一种或两种。
[实验探究]
|
|
实验操作 |
预期现象 |
结 论 |
|
验证猜想Ⅰ |
步骤①:取少量0.01
mol/L 酸性KMnO4溶液,滴入所得溶液 |
|
|
|
步骤②:
|
|
含有Fe3+ |
|
|
验证猜想Ⅱ |
将所得气体通入如下装置 |
|
含有两种气体 |
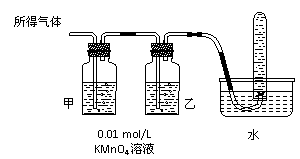

[问题讨论]
有同学提出,若另外选用KSCN溶液,则仅利用KSCN和H2O2两种溶液即可完成猜想Ⅰ的所有探究,判断该方法是否正确并进行评价:
[答案]
SO2、H2
猜想Ⅰ
步骤① 溶液紫红色褪去 含有Fe2+
步骤② 另取少量所得溶液,滴加KI溶液和淀粉溶液 溶液变为蓝色
猜想Ⅱ
甲中KMnO4溶液褪色,乙中KMnO4溶液颜色不变,试管中收集到气体
不正确 若溶液中含有Fe3+则无法检验溶液中是否含有Fe2+
12.(2010·济南外国语学校模拟)实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的是( )
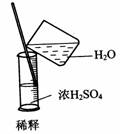
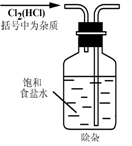 A.
B.
A.
B.

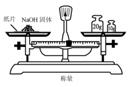 C.
D.
C.
D.
[解析]选D。A选项进气口反了;不能在量筒中稀释浓硫酸,同时稀释浓硫酸不能够将水倒入浓硫酸中,B选项错误;应该用玻璃容器来盛放氢氧化钠,C选项错误;D选项正确。
11.(2010·海南模拟)下列有关化学实验的叙述正确的是( )
A.可用25ml碱式滴定管量取20.00ml KMnO4 溶液
B.除去乙醇中少量的乙酸:加足量生石灰,蒸馏
C.用苯萃取溴水中的溴,分液时有机层从分液漏斗的下口放出
D.向SO2水溶液中滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,说明BaSO3难溶于盐酸
[解析]选B。量取KMnO4 溶液,应该用酸性滴定管,A选项错误;除去乙醇中少量的乙酸,加足量生石灰,乙酸与生石灰反应生成醋酸钙,由于两者沸点相差很大,可以用蒸馏的方法分离,B选项正确;用苯萃取溴水中的溴,因为苯的密度比水的密度小,有机层在上层,因此C选项错误;向SO2水溶液中滴加盐酸酸化的BaCl2溶液,不会有白色沉淀生成,因为盐酸的酸性比亚硫酸的酸性强,D选项错误。
10.(2010·中山模拟)下列有关实验的说法正确的是( )
A.除去铁粉中混有的少量铝粉,可加入过量的氢氧化钠溶液,完全反应后过滤
B.为测定熔融氢氧化钠的导电性,可在瓷坩埚中熔化氢氧化钠固体后进行测量
C.制备Fe(OH)3胶体,通常是将Fe(OH)3固体溶于热水中
D.某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液中一定含有CO32-
[解析]选A。熔融氢氧化钠能够与瓷坩埚成分二氧化硅发生反应,因此B选项错误;将氯化铁溶液滴入热水中制备Fe(OH)3胶体,C选项错误;不能排除碳酸氢根离子、亚硫酸根离子、亚硫酸氢根离子的干扰,因此D选项错误。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com