
例14.(09年全国1)为了检验某含有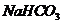 杂质的
杂质的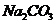 样品的纯度,现将
样品的纯度,现将 克
克
样品加热,其质量变为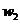 g,,则该样品的纯度(质量分数)是
g,,则该样品的纯度(质量分数)是
A. B.
B.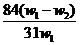 C.
C. D.
D.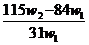
[解析]2NaHCO3 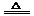 Na2CO3 + CO2↑
+ H2O m (减少)
Na2CO3 + CO2↑
+ H2O m (减少)
2×84 106 62
x (W1- w2)
解得x= ,将其带入下式可得: w(Na2CO3)=
(w1- x )/W1 =
,将其带入下式可得: w(Na2CO3)=
(w1- x )/W1 =  ,A项正确。
,A项正确。
[答案]A
例12.把铝条放入盛有过量稀盐酸的试管中,不影响氢气产生速率的因素是
A.盐酸的浓度 B.铝条的表面积
C.溶液的温度 D.加少量Na2SO4
[解析]铝与盐酸反应的实质是2Al+6H+=2Al3++3H2↑,因此盐酸的溶度、铝条的表面积和溶液的温度均会影响反应的速率,而加少量Na2SO4对溶液中的各物质的浓度没有影响,不会影响反应速率。
[答案]D
 例13.(09江苏卷
例13.(09江苏卷 16)以氯化钾和钛白厂的副产品硫酸亚铁为原料生产硫酸钾、过二硫酸钠和氧化铁红颜料,原料的综合利用率较高。其主要流程如下:
16)以氯化钾和钛白厂的副产品硫酸亚铁为原料生产硫酸钾、过二硫酸钠和氧化铁红颜料,原料的综合利用率较高。其主要流程如下:


 (1)反应I前需在
(1)反应I前需在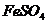 溶液中加入 ▲
(填字母),以除去溶液中的
溶液中加入 ▲
(填字母),以除去溶液中的 。
。
 A.锌粉 B.铁屑 C.KI溶液 D.
A.锌粉 B.铁屑 C.KI溶液 D.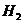
 (2)反应Ⅰ需控制反应温度低于35℃,其目的是
。
(2)反应Ⅰ需控制反应温度低于35℃,其目的是
。
 (3)工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是
。
(3)工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是
。
 (4)反应Ⅳ常被用于电解生产
(4)反应Ⅳ常被用于电解生产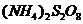 (过二硫酸铵)。电解时均用惰性电极,阳极发生地电极反应可表示为
。
(过二硫酸铵)。电解时均用惰性电极,阳极发生地电极反应可表示为
。
 解析:
解析:
(1)在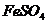 溶液中除去溶液中的
溶液中除去溶液中的 ,最好选用铁屑或铁粉,比较简单。
,最好选用铁屑或铁粉,比较简单。
(2)如果温度过高会导致NH4HCO3分解同样也会加快Fe2+的水解(温度越高水解速率越快)这样会使原料利用率降低。
(3)由题目看出在III反应中生成的K2SO4 为固体,而K2SO4在无机溶剂中溶解度是比较大的,要想使K2SO4析出只能降低其溶解度所以加入醇类溶剂目的降低K2SO4 的溶解度。
 (4)根据阴阳极反应原理阳极失电子发生氧化反应, 此题实质是电解硫酸铵溶液,在根据反应后的产物得出正确的答案。
(4)根据阴阳极反应原理阳极失电子发生氧化反应, 此题实质是电解硫酸铵溶液,在根据反应后的产物得出正确的答案。
 [答案](1)B
[答案](1)B (2)防止NH4HCO3分解(或减少Fe2+的水解)
(2)防止NH4HCO3分解(或减少Fe2+的水解)
 (3)降低K2SO4
的溶解度,有利于K2SO4
析出。
(3)降低K2SO4
的溶解度,有利于K2SO4
析出。 (4)2SO42-
-2e-
(4)2SO42-
-2e- 2S2O82-
2S2O82-
[例11]控制适合的条件,将反应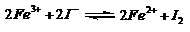 设计成如右图所示的原
设计成如右图所示的原
电池。下列判断不正确的是
 A. 反应开始时,乙中石墨电极上发生氧化反应
A. 反应开始时,乙中石墨电极上发生氧化反应
 B. 反应开始时,甲中石墨电极上Fe3+被还原
B. 反应开始时,甲中石墨电极上Fe3+被还原
 C. 电流计读数为零时,反应达到化学平衡状态
C. 电流计读数为零时,反应达到化学平衡状态
 D. 电流计读数为零后,在甲中溶入FeCl2固定,乙中石墨电极为负极
D. 电流计读数为零后,在甲中溶入FeCl2固定,乙中石墨电极为负极
[解析]乙中I-失去电子放电,故为氧化反应,A项正确;由总反应方程式知,Fe3+被还原成Fe2+,B项正确;当电流计为零时,即说明没有电子发生转移,可证明反应达平衡,C项正确。加入Fe2+,导致平衡逆向移动,则Fe2+失去电子生成Fe3+,而作为负极,D项错。
[答案]D
例9.(09年宁夏理综·27)(15分)下图表示有关物质(均由短周期元素形成)之间
的转化关系,其中A为常见的金属单质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化合物。(反应条件图中已省略。)

(1)A、B、C、D代表的物质分别为 、 、 、 (填化学式);
(2)反应①中的C、D均过量,该反应的化学方程式是 ;
(3)反应②中,若B与F物质的量之比为4∶3,G、H分别是 、 (填化学式);
(4)反应③产物中K的化学式为 ;
(5)反应④的离子方程式为 。
[解析]D是淡黄色的固体化合物是本题的突破口,根据中学化学知识基本锁定Na2O2,能与水和CO2反应,但是题目另一信息C是常见的无色无味液体说明C是水,则G为CO2;再依据K能溶于水,说明K为Na2CO3 ,F为O2; 题给信息黑色单质B与氧气(F)反应得到G(CO2),说明B为C(碳);依据F(O2)与E反应生成C(水)可知E为氢气,再根据金属A与碱性溶液反应产生氢气,可得到A为Al.
[答案](1)Al C Na2O2 (2)2H2O +Na2O2 =4NaOH+O2↑
2Al+ 2NaOH+2H2O=2NaAlO2+3H2↑
(3)CO2 CO (4)Na2CO3 (5)2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
例10.(08年宁夏理综·26)
某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。

填写下面空白。
(1)图中标号处需加入的相应物质分别是① 、② 、③ 、④ 、⑤ ;
(2)写出①处发生反应的离子方程式 ;写出③处发生反应的化学方程式 ;
(3)铁红的化学式为 ;分别写出铁红和氧化铜在工业上的一种主要用途:铁红 ;氧化铜 。
[解析]首先用过量铁屑将H+、Fe3+、Cu2+、Au3+等离子还原成H2、Fe2+、Cu、Au,发生4个反应,E中应为Fe2+,因为后面生成铁红,故⑤为碱液氢氧化钠,试剂②是将过量铁屑溶解,试剂③是将Cu、Au分离应为稀硝酸,从C中的Cu2+到氧化铜,也应为碱液氢氧化钠。
[答案]
(1)①铁屑 ②稀硫酸 ③稀硝酸 ④氢氧化钠 ⑤氢氧化钠
(2)Fe+2H+=Fe2++H2↑ 2Fe3++Fe=3Fe2+
Cu2++Fe=Cu+Fe2+ 2Au3++3Fe=2Au+3Fe2+
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(3)Fe2O3 用作红色涂料 用作制造铜盐的原料
例8.(09年广东)出土的锡青铜(铜锡合金)文物常有Cu2(OH)3Cl覆盖在其表面。下列说法正确的是
 A. 锡青铜的熔点比纯铜高
A. 锡青铜的熔点比纯铜高
 B.在自然环境中,锡青铜中的锡对铜起保护作用
B.在自然环境中,锡青铜中的锡对铜起保护作用
 C.锡青铜文物在潮湿环境中的腐蚀比干燥环境中快
C.锡青铜文物在潮湿环境中的腐蚀比干燥环境中快
 D.生成Cu2(OH)3Cl覆盖物是电化学腐蚀过程,但不是化学反应过程
D.生成Cu2(OH)3Cl覆盖物是电化学腐蚀过程,但不是化学反应过程
 [解析]锡青铜属于合金根据合金的特性,熔点比任何一种纯金属的低判断A错;由于锡比铜活泼,故在发生电化学腐蚀时,锡失电子保护铜,B正确;潮湿的环境将会加快金属的腐蚀速率,C正确;电化学腐蚀过程实质是有电子的转移,属于化学反应过程,D错。
[解析]锡青铜属于合金根据合金的特性,熔点比任何一种纯金属的低判断A错;由于锡比铜活泼,故在发生电化学腐蚀时,锡失电子保护铜,B正确;潮湿的环境将会加快金属的腐蚀速率,C正确;电化学腐蚀过程实质是有电子的转移,属于化学反应过程,D错。
 答案:BC
答案:BC

 例6(09年福建)
例6(09年福建) 从铝土矿(主要成分是
从铝土矿(主要成分是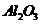 ,含
,含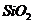 、
、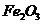 、MgO等杂质)中提取两种工艺品的流程如下:
、MgO等杂质)中提取两种工艺品的流程如下:


 请回答下列问题:
请回答下列问题:
 (1)流程甲加入盐酸后生成Al3+的方程式为_________.
(1)流程甲加入盐酸后生成Al3+的方程式为_________.
 (2)流程乙加入烧碱后生成Si
(2)流程乙加入烧碱后生成Si 的离子方程式为________.
的离子方程式为________.
 (3)验证滤液B含
(3)验证滤液B含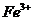 ,可取少量滤液并加入________(填试剂名称)。
,可取少量滤液并加入________(填试剂名称)。
 (4)滤液E、K中溶质的主要成份是________(填化学式),写出该溶液的一种用途________
(4)滤液E、K中溶质的主要成份是________(填化学式),写出该溶液的一种用途________
 (5)已知298K时,
(5)已知298K时,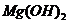 的容度积常数
的容度积常数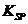 =5.6×
=5.6× ,取适量的滤液B,加入一定量的烧碱达到沉淀溶液平衡,测得PH=13.00,则此温度下残留在溶液中的
,取适量的滤液B,加入一定量的烧碱达到沉淀溶液平衡,测得PH=13.00,则此温度下残留在溶液中的 =_______.
=_______.
[解析]本题考查铝土矿中氧化铝提取的工艺流程。(1)与HCl反应生成Al3+,应为铝土矿中Al2O3。(2)SiO2可以溶于NaOH中生成Na2SiO3。(3)检验Fe3+的特征反应很多,如与KSCN显血红色,与苯酚显紫色,与OH-显红褐色沉淀等。(4)生成E、K时,CO2均是过量的,故应生成NaHCO3。(5)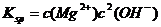 ,
,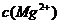 =5.6×10-12/(0.1)2=5.6×10-10。
=5.6×10-12/(0.1)2=5.6×10-10。
[答案](1)Al2O3 + 6H+  2Al3+ +3H2O (2)SiO2 + 2OH-
2Al3+ +3H2O (2)SiO2 + 2OH-  SiO32 - + H2O
SiO32 - + H2O
(3)硫氰化钾(或硫氰酸钾、苯酚溶液等合理答案)
(4)NaHCO3;制纯碱或做发酵粉等合理答案 (5)5.6×10-10mol/L
例 7.(09年江苏化学·5)化学在生产和日常生活中有着重要的应用。下列说法不正确的
7.(09年江苏化学·5)化学在生产和日常生活中有着重要的应用。下列说法不正确的
是 ( )
 A.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
A.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
 B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
 C.MgO的熔点很高,可用于制作耐高温材料
C.MgO的熔点很高,可用于制作耐高温材料
 D.电解MgCl2饱和溶液,可制得金属镁
D.电解MgCl2饱和溶液,可制得金属镁
 解析:A项,明矾净水的原理是Al3++3H2O
解析:A项,明矾净水的原理是Al3++3H2O Al(OH)3(胶体)+3H+,利用Al(OH)3(胶体)的吸附性进行净水;B项,是因为轮船主要用铁造外壳,铁在海水中易被腐蚀.镀上比铁活泼的锌,形成原电池,锌作负极,失去电子先被腐蚀,从而起到保护铁的作用,从而可减缓船体的腐蚀速率;氧化镁的熔点是2852℃,可用于制作耐高温材料;电解MgCl2饱和溶液,发生地化学反应为MgCl2+2H2O
Al(OH)3(胶体)+3H+,利用Al(OH)3(胶体)的吸附性进行净水;B项,是因为轮船主要用铁造外壳,铁在海水中易被腐蚀.镀上比铁活泼的锌,形成原电池,锌作负极,失去电子先被腐蚀,从而起到保护铁的作用,从而可减缓船体的腐蚀速率;氧化镁的熔点是2852℃,可用于制作耐高温材料;电解MgCl2饱和溶液,发生地化学反应为MgCl2+2H2O Mg(OH)2+Cl2↑+H2↑,不会产生金属镁,电解熔融的MgCl2能制取单质镁,发生的反应MgCl2(熔融)
Mg(OH)2+Cl2↑+H2↑,不会产生金属镁,电解熔融的MgCl2能制取单质镁,发生的反应MgCl2(熔融) Mg+Cl2↑。
Mg+Cl2↑。
 答案:D
答案:D
例4.(09年海南化学·3)除去NaHCO3溶液中混有的少量Na2CO3可采取的方法是:
A.通入二氧化碳气体 B.加入氢氧化钡溶液
C.加入澄清石灰水 D.加入稀盐酸
[解析]除杂方法要操作简便、效果好、不带来新的杂质、保留非杂质成份。溶液中可用这样的方法: Na2CO3 + H2O + CO2 = 2NaHCO3。
[答案]A
例5. 某天然碱(纯净物)可看作由CO2和NaOH反应后的产物所组成。称取天然碱样品四份,溶于水后,分别逐滴加入相同浓度的盐酸溶液30mL,产生CO2的体积(标准状况)如下表:(2000年上海高考题)
|
|
Ⅰ |
Ⅱ |
Ⅲ |
Ⅳ |
|
盐酸液的体积(mL) |
30 |
30 |
30 |
30 |
|
样品(g) |
3.32 |
4.15 |
5.81 |
7.47 |
|
二氧化碳的体积(mL) |
672 |
840 |
896 |
672 |
(1)由第Ⅰ组数据中的CO2体积与样品质量之比,可以推测用2.49 g样品进行同样的实验时,产生CO2_________mL(标准状况)。
(2)另取3.32g天然碱样品于300℃加热分解至完全(300℃时Na2CO3不分解),产生CO2112mL(标准状况)和水0.45g,计算并确定该天然碱的化学式。
(3)已知Na2CO3和HCl(aq)的反应分下列两步进行:
Na2CO3+HCl→NaCl+NaHCO3 Na2CO3+HCl→NaCl+CO2↑+H2O
由上表中第Ⅳ组数据可以确定所用的HCL(aq)的浓度为 mol/L。
(4)依据上表所列数据以及天然碱的化学式,讨论并确定上述实验中CO2(标准状况)体积V(mL)与样品质量W(g)之间的关系式。
[解析]试题以天然碱的组成及碳酸盐的性质为依托,构筑一道有层次、有深度且思维容量较大的计算题。对信息的理解能力、对数据的观察和处理能力是解答本题的关键。
(1)(672 mL/3.32 g)×2.49 g=504 mL。
(2)由题意可知,天然碱含NaHCO3、Na2CO3。
n(NaHCO3)=2n(CO2)=2×(112/22400)mol=0.01mol n(Na2CO3)=(672/22400)mol-0.01mol=0.02mol n(H2O)=[(0.45g-(112/22400)mol×18mol)/18mol=0.02mol
所以天然碱组成为2Na2CO3.NaHCO3.2H2O(式量332)。
(3)7.47 g样品中:n(Na2CO3)=(7.47 g/332 g.mol-1)×2=0.045 mol,则:
Na2CO3完全生成NaHCO3消耗HCl:0.045mol;生成672mLCO2消耗HCl:672mL/22400 mL.mol-1=0.03 mol。故c(HCl)=(0.045 mol+0.03 mol)/0.030 L=0.025 mol/L。
(4)30ml盐酸中n(HCl)=0.075mol,设样品与HCl反应全转化为NaCl,由:
2Na2CO3.NaHCO3+5HCl=5NaCl+3CO2↑+3H2O知:需样品质量:(0.075mol/5)×332 g/mol=4.98 g
设样品中Na2CO3与HCl反应完全转化为NaHCO3(无CO2气体放出),由:
(2Na2CO3.NaHCO3)+2HCl=2NaCl+3NaHCO3知:需样品质量:(0.075mol/2)×332 g/mol=12.45g
讨论:①0<W≤4.98,HCl过量:V(CO2)=(W g/332 g.mol-1×3)×22400 mL.mol-1=202.4W mL
②4.98≤W≤12.45,Na2CO3转化NaHCO3消耗n(HCl)=(W g/332 g.mol-1)×2;剩余n(HCl)= 0.075mol-(Wg/332g.mol-1)×2,生成CO2物质的量等于剩余HCl物质的量,故V(CO2)=[0.075mol-(W g/332 g.mol-1×2)]×22400 mL/mol=(1860mL-134.9W) mL
③W≤12.45,HCl全部用于使Na2CO3转化NaHCO3,故V(CO2)=0。
[答案](1)504 (2)2Na2CO3·NaHCO3·2H2O (3)2.5 (4)①0<W≤4.98 V(CO2)=202.4W mL或V(CO2)= (W g/332 g.mol-1×3)×22400 mL.mol-1;②4.98≤W≤12.45 V(CO2)=1680-134.9W mL或V(CO2)=[0.075mol-(W g/332 g.mol-1×2)]×22400 mL/mol;③12.45≤W V(CO2)=0
例2.(08年广东文基·64)铁和铁合金是生活中常用的材料,下列说法正确的是B
A.不锈钢是铁合金,只含金属元素
B.一定条件下,铁粉可与水蒸气反应
C.铁与盐酸反应,铁合金不与盐酸反应
D.在空气中,铁板比镀锌铁板更耐腐蚀
[解析]本题考查了常见金属铁及其合金,金属腐蚀的有关知识。铁是一种较活波的金属单质,在高温的条件下可以与水蒸气反应,A为正确选项,不锈钢是由普通钢中加入铬、镍等多种元素炼成的钢材,里面含有C元素,B是错项。C项铁在氢的前面,能与盐酸反应,铁合金主要成分是铁,能与盐酸反应,是错项,很多同学误选这项,只看了前面的内容,后面不看。金属的腐蚀与金属的活波性有关,越活波,越易被腐蚀,因此D为错项。
[答案]A
例3.(07年广东文基·65)下列说法正确的是
A.我国流通的硬币材质是金属单质
B.所有的不锈钢都只含有金属元素
C.镁合金的硬度和强度均高于纯镁
D.广东正在打捞的明代沉船上存在大量铝制餐具
[解析]有些不锈钢中还含有碳或硅元素,故A选项错误;我国流通的硬币是一种合金;合金的硬度和强度等机械性能要好于成分金属;铝在海洋中很容易被腐蚀。因此正确选项为C。
[答案]C
例1.(09年北京)W、X、Y、Z均为短周期元素,W的最外层电子数与核外电子总数之比为7:17;X与W同主族;Y的原子序数是W和X的原子序数之和的一半;含Z元素的物质焰色反应为黄色。下列判断正确的是
A.金属性:Y Z
B 氢化物的沸点:
Z
B 氢化物的沸点: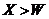
C.离子的还原性: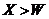 D 原子及离子半径:
D 原子及离子半径:
[解析]有上信息可知W、X、Y、Z分别为Cl、F、Mg、Na
[答案]B
1.从高处自由下落的物体,它的重力势能Ep和机械能E随高度h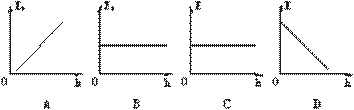 的变化图线如图所示,正确的是
的变化图线如图所示,正确的是
⒉如图所示,小球从高处下落到竖直放置的轻弹簧上,在弹簧压缩到最短的整个过程中,下列关于能量的叙述中正确的应是
 A.重力势能和动能之和总保持不变。
A.重力势能和动能之和总保持不变。
B.重力势能和弹性势能之和总保持不变。
C.动能和弹性势能之和保持不变。
D.重力势能、弹性势能和动能之和总保持不变。
⒊一个质量为m的物体以a=2g的加速度竖直向上运动,则在此物体上升h的过程中,物体的
A重力势能增加了2mgh B 动能增加了2mgh
C机械能保持不变 D机械能增加了mgh
⒋当物体克服重力做功时,物体的
A重力势能一定减少,机械能可能不变。
B重力势能一定增大,机械能一定增大。
C重力势能一定减少,动能可能减小。
D重力势能一定增大,动能可能不变。
⒌某同学身高⒈8m,在运动会上他参加跳高比赛,起跳后身体横着越过了⒈8m高的横杆,据此可估算出他起跳高时竖直向上的速度大约为
A 2m/S B 4m/S C 6m/S D 8m/S
⒍质量为1㎏的物体在地面上高20m的地方在一拉力的作用下以7m/㎡的加速度竖直下落5m的过程中,物体的机械能改变量是
A 5J B 10J C 15J D 20J
⒎ 如图所示,轻质弹簧一端与墙相连,质量为4㎏的木块沿光滑的水平面以V0=5m/S
的速度运动并压缩弹簧K,求弹簧在被压缩的过程中的最
 大弹性能以及木块的速度V1=3m/S时的弹簧的弹性势能?
大弹性能以及木块的速度V1=3m/S时的弹簧的弹性势能?
⒏ 气球以10m/S的速度匀速上升,当它上升到离地15m的高空时,从气球上掉下一个物体,若不计空气阻力,求物体落地的速度是多少?

⒐ 质量为50㎏的跳水运动员,从1m的跳板上向上跳
起,最后以⒐8m/S的速度入水,不计空气阻力,取g
=9.8m/S2,求 ⑴ 跳板对运动员做的功是多少?
⑵ 运动员在空中的最大高度离跳板多高?
⒑一根长细绳绕过光滑的定滑轮,两端分别系住质量为M和m的物体,且M>m,开始时用手握住M,使系统处于如图所示的状态,如果M下降h刚好触地,那么m能上升的高度是多少?

[学后反思]________________________________________________________________
____________________________________________________________________________
____________________________________________________________________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com