
曾经有老师问我,她写论文时,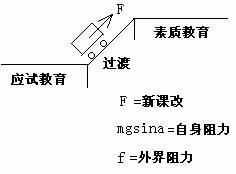 想用素质教育这个词,这个词是否已经过时了?我回答:素质教育不但没有过时,而且几个月前,《中国教育报》还专门对当前的素质教育进行系列讨论。应该说:我们现在正处在应试教育向素质教育过渡期,提高全民素质是我们努力的方向。教育部长周济曾经说:现在我们说应试教育的倾向还是比较严重的,中小学生的负担确实比较重,这是事实,但不能说现在应试教育占主导地位。现在的教育确实存在很多需要改进的地方。但应该承认,我们国家基础教育总的质量还是好的。
想用素质教育这个词,这个词是否已经过时了?我回答:素质教育不但没有过时,而且几个月前,《中国教育报》还专门对当前的素质教育进行系列讨论。应该说:我们现在正处在应试教育向素质教育过渡期,提高全民素质是我们努力的方向。教育部长周济曾经说:现在我们说应试教育的倾向还是比较严重的,中小学生的负担确实比较重,这是事实,但不能说现在应试教育占主导地位。现在的教育确实存在很多需要改进的地方。但应该承认,我们国家基础教育总的质量还是好的。
那么,新课改就是应试教育向素质教育过渡的推动力。为了更好地理解我们现在所处的位置,我设计了一个物理插图来说明这个过程。图中含义:
①图的外观含义:这是用物理图来说明我个人认为的当前我们所处的位置,即:正处于过渡期(斜面上),而新课改正是促进过渡的推动力(牵引力)。
②过渡期太短,势必倾角过大,则自身阻力就越大。
③新课改的推动力与内外阻力合力的大小关系,又决定着过渡的进程。
④小车代表“教育”还是代表“教师”、“学生”,你感觉是什么就是什么。
⑤还有其它什么还以,你可以自己继续分析。
本次新课程改革是经历了3年研制,征求了包括50多名院士在内的社会各界意见的改革,经过了从2001年9月份以来的实验,所以有专家认为,其意义不亚于1977年恢复高考。所以,教育部马司长说:“课程改革的浪潮滚滚而来,新世纪的中小学教师必须接受新一轮课改浪潮的洗礼。”
9.(07年广东化学·23)
已知某混合金属粉末中,除铝外还含有铁、铜中的一种或两种,所含金属的量都在5%以上。请设计合理实验探究该混合物金属粉末中铁、铜元素的存在。
仅限选择的仪器和试剂:烧杯、试管、玻璃棒、量筒、容量瓶、滴管、药匙;1mol·L-1硫酸、2mol·L-2硝酸、2mol·NaOH溶液、20%KSCN溶液。
完成以下实验探究过程:
(1)提出假设:
假设1:该混合金属粉末中除铝外还含有 元素;
假设2:该混合金属粉末中除铝外还含有 元素;
假设3:该混合金属粉末中除铝外还含有Fe、Cu元素;
(2)设计实验方案基于假设3,设计出实验方案(不要在答题卡上作答)。
(3)实验过程
根据(2)的实验方案,叙述实验操作、预期现象和结论。
[提示]Ⅰ.在答题卡上按以下方式作答,注意前后内容对应;
8.(09年四川)
向m g镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体b L。
向反应后的溶液中加入c mol/L氢氧化钾溶液V mL,使金属离子刚好沉淀完全,得到的
沉淀质量为n g。再将得到的沉淀灼烧至质量不再改变为止,得到固体p g。则下列关系不
正确的是
A.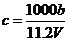 B.
B.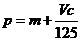 C.n=m+17Vc D.
C.n=m+17Vc D.
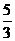 <
< 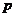 <
<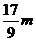
7.(09年广东理基·25)钢铁生锈过程发生如下反应:
①2Fe+O2+2H2O=2Fe(OH)2;
②4Fe(OH)2+O2+2H2O=4Fe(OH)3;
③2Fe(OH)3=Fe2O3+3H2O。
下列说法正确的是
A.反应①、②中电子转移数目相等
B.反应①中氧化剂是氧气和水
C.与铜质水龙头连接处的钢质水管不易发生腐蚀
D.钢铁在潮湿的空气中不能发生电化学腐蚀
6. (09年福建理综·7)能实现下列物质间直接转化的元素是
(09年福建理综·7)能实现下列物质间直接转化的元素是

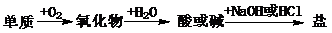
 A.硅 B.硫 C.铜 D.铁
A.硅 B.硫 C.铜 D.铁
5.(08年江苏化学·13)研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到的直观形象的效果。下列表达不正确的是
A.密闭容器中CuO和C高温反应的气体产物: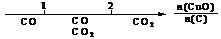
B.Fe在Cl2中的燃烧产物: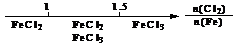
C.AlCl3溶液中滴加NaOH后铝的存在形式:
D.氨水与SO2反应后溶液中的铵盐: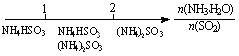
4.(08年广东文基·64)铁和铁合金是生活中常用的材料,下列说法正确的是
A.不锈钢是铁合金,只含金属元素
B.一定条件下,铁粉可与水蒸气反应
C.铁与盐酸反应,铁合金不与盐酸反应
D.在空气中,铁板比镀锌铁板更耐腐蚀
3.(08年广东化学·12)下列有关金属腐蚀与防护的说法正确的是
A.纯银器表面在空气中因化学腐蚀渐渐变暗
B.当镀锡铁制品的镀层破损时,镶层仍能对铁制品起保护作用
C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
2.(08年广东化学·6)相同质量的下列物质分别与等浓度的NaOH溶液反应,至体系中均无固体物质,消耗碱量最多的是
A.Al B.Al(OH)3 C.Al Cl3 D.Al2O3
例15.(08年海南化学·16)现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。已知实验中可能会发生下列反应:
①2Mg+O2 2MgO;②3Mg+N2
2MgO;②3Mg+N2
 Mg3N2;③2Mg+CO2
Mg3N2;③2Mg+CO2 2MgO+C;
2MgO+C;
④Mg+H2O MgO+H2↑;⑤Mg3N2 +6H2O =3Mg(OH)2↓+2NH3↑
MgO+H2↑;⑤Mg3N2 +6H2O =3Mg(OH)2↓+2NH3↑
可供选择的装置和药品如下图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连)。
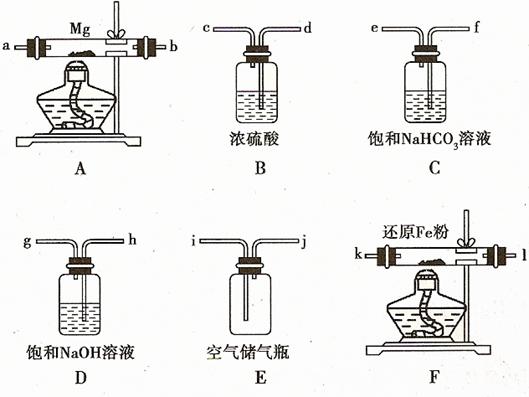
回答下列问题;
(1)在设计实验方案时,除装置A、E外,还应选择的装置(填字母代号)及其目的分别 。
(2)连接并检查实验装置的气密性。实验开始时,打开自来水的开关,将空气从5升的储气瓶压入反应装置,则气流流经导管的顺序是(填字母代号) 。
(3)通气后,如果同时点燃A、F装置的酒精灯,对实验结果有何影响? ,原因是 。
(4)请设计一个实验,验证产物是氮化镁: 。
[解析]本实验的目的是:在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2),
而在实验中,氧气、二氧化碳和水都能与镁反应,所以在把氮气通入A之前要除去空气中的氧气、二氧化碳和水蒸气,除去氧气要用装置F,除去二氧化碳要用装置D,除去水蒸气要用装置B,并且除去的由前到后的顺序为:二氧化碳-水蒸气(从装置D中会带出水蒸气)-氧气。
[答案](1)B 目的是除去空气中的水蒸气,避免反应④发生;D 目的是除去空气中的CO2,避免反应③发生;F 目的是除去空气中的O2,避免反应①发生。
(2)j→h→g→d→c→k→l(或l→k)→a→b(或b→a)
(3)制得的氮化镁将不纯 因为A装置没有排完空气前就加热会让空气中的氧气、CO2、水蒸气等与镁反应
(4)将产物取少量置于试管中,加入适量水,将润湿的红色石蕊试纸置于试管口,如果能够看到润湿的红色石蕊试纸变蓝,则说明产物是氮化镁
例16.(08年广东化学·22)
铜在自然界存在于多种矿石中,如:
|
矿石名称 |
黄铜矿 |
斑铜矿 |
辉铜矿 |
孔雀石 |
|
主要成分 |
CuFeS2 |
Cu5FeS4 |
Cu2S |
CuCO3·Cu(OH)2 |
请回答下列问题:
(1)上表所列铜化合物中,铜的质量百分含量最高的是 。
(2)工业上以黄铜矿为原料。采用火法溶炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+Cu2S 6Cu+SO2↑,反应的氧化剂是 。
6Cu+SO2↑,反应的氧化剂是 。
(3)SO2尾气直接排放到大气中造成环境污染的后果是 ;处理该尾气可得到有价值的化学品,写出其中1种酸和1种盐的名称 。
(4)黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制。请简述粗铜电解得到精铜的原理: 。
(5)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是 (填字母)。
|
选项 |
陈述Ⅰ |
陈述Ⅱ |
判断 |
|
A |
铜绿的主成分是碱酸铜 |
可用稀盐酸除铜器表面的铜绿 |
Ⅰ对;Ⅱ对;有 |
|
B |
铜表易形成致密的氧化膜 |
铜容器可以盛放浓硫酸 |
Ⅰ对;Ⅱ对;有 |
|
C |
铁比铜活泼 |
例在铜板上的铁钉在潮湿空气中不易生锈 |
Ⅰ对;Ⅱ对;有 |
|
D |
蓝色硫酸铜晶体受热转化为白色硫酸铜粉末是物理变化 |
硫酸铜溶液可用作游泳池的消毒剂 |
Ⅰ错;Ⅱ对;无 |
[解析]
(1)上表所列铜化合物中,铜的质量百分含量最高的是Cu2S
解释:CuFeS2:34.8% ;Cu5FeS4:63.5% ;Cu2S:80% ;CuCO3·Cu(OH)2:57.6%
(2) 反应的氧化剂是Cu2O,Cu2S
解释:Cu2O,Cu2S的Cu由+1被还原为0价,作氧化剂;Cu2S的S有-2价被氧化为+4价,作还原剂。
(3)SO2尾气直接排放到大气中造成环境污染的后果是形成酸雨。处理该尾气可得到有价值的化学品,写出其中1种酸和1种盐的名称硫酸,硫酸铵。
解释:处理SO2尾气一般为循环制备硫酸,和用Ca(OH)2或氨水吸收,可得到CaSO4和(NH4)2SO4等有价值的化学品。
(4) 简述粗铜电解得到精铜的原理:电解池中,粗铜作阳极,精铜作阴极,电解质为硫酸铜溶液。阳极上发生氧化反应,Cu失去电子,使Cu单质变为Cu2+进入溶液中Cu- e- == Cu2+;阴极上发生还原反应,Cu2+得到电子在阴极上析出Cu单质,Cu2++ e- == Cu,从而达到精制Cu的目的。
(5) 稀盐酸可以同Cu(OH)2与CuCO3反应,而且稀盐酸不能于Cu反应。所以稀盐酸可以除铜器表面的铜绿(CuCO3·Cu(OH)2),A正确。铜表面不能形成致密氧化膜;铜和浓硫酸在常温下是反应的,生成硫酸铜、SO2和水,反应很慢,反应过程中放热,随着反应的进行,速率会越来越快的,所以不能用铜制容器装浓硫酸,B错误。因为Fe比Cu活泼,所以Fe-Cu形成的原电池中,Fe作负极,更容易被氧化生绣,C错误。蓝色硫酸铜晶体受热转化为白色硫酸铜粉末,只有旧键的断裂,没有新键的形成(CuSO4·5H2O中,H2O与Cu2+有配位键),故不属于化学变化,只有物理变化;CuSO4可用作消毒剂,但与前者没有因果关系,D正确。
综上所述,答案选AD。
[答案](11分)(1)Cu2S (2)Cu2O,Cu2S (3)形成酸雨,会对植物和建筑物造成严重损害 硫酸 硫酸铵 电解池中,粗铜作阳极,精铜作阴极,电解质为硫酸铜溶液。阳极上发生氧化反应,Cu失去电子,使Cu单质变为Cu2+进入溶液中Cu-2e- === Cu2+;阴极上发生还原反应,Cu2+得到电子在阴极上析出Cu单质,Cu2++2e- === Cu,从而达到精制Cu的目的 (5)A D
[专题突破]
1.(07年广东化学·12)为了避免青铜器生成铜绿,以下方法正确的是
A.将青铜器放在银质托盘上
B.将青铜器保存在干燥的环境中
C.将青铜器保存在潮湿的空气中
D.在青铜器的表面覆盖一层防渗的高分子膜
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com