
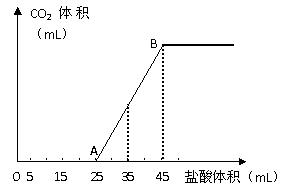
23、(9分)将2.5g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol·L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示:
(1)写出OA段所发生反应的离子方程式
________________________________________________
__________________________________________ 。
(2)当加入35mL盐酸时,产生CO2的体积为___________mL(标准状况)。
(3)计算原混合物中NaOH的质量及碳酸钠的质量分数。
22.(10分)有下列化学仪器:
①托盘天平②玻璃棒③药匙④烧杯⑤量筒⑥容量瓶⑦胶头滴管⑧细口试剂瓶⑨标签纸
(1)现需要配制500m L 1mol/L H2SO4溶液,需要质量分数为98%,密度为1.84g/cm3的浓H2SO4 ;
(2)从上述仪器中,按实验要求使用的先后顺序,其编号排列是 ;
(3)容量瓶使用前检验漏水的方法是 ;
(4)若实验遇到下列情况,对硫酸溶液的物质的量浓度有何影响(填“偏高”“偏低”或“不变”)
①用以稀释浓硫酸的烧杯未洗涤, ;
②未经冷却将溶液注入容量瓶中, ;
③摇匀后发现液面下降再加水, ;
④定容时观察液面俯视, 。
21、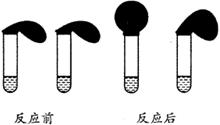 (11分)有这样一个实验:在两支试管中分别加入3mL某浓度的稀盐酸(足量),将两个各装有0.3g NaHCO3和 Na2CO3粉末的小气球分别套在两支试管口。将气球内的NaHCO3和Na2CO3同时倒入试管中,观察到现象如右图:
(11分)有这样一个实验:在两支试管中分别加入3mL某浓度的稀盐酸(足量),将两个各装有0.3g NaHCO3和 Na2CO3粉末的小气球分别套在两支试管口。将气球内的NaHCO3和Na2CO3同时倒入试管中,观察到现象如右图:
(1)盛______________(填化学式)的试管中气球变得更大, 大小气球(不计气球的弹力和气体温度影响) 体积之比约为(填最简单整数比)____________。
(2)甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3粉末的试管变热。由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应。甲同学写出了如下热化学方程式(其中“aq”代表水合或无限稀释的含义):
HCO3-(aq)+ H+(aq) →H2O(l)+ CO2(g) ΔH1 ; ΔH1>0
CO32-(aq)+ 2H+(aq) → H2O(l) + CO2(g) ΔH2 ; ΔH2<0
甲同学所作结论的方法是否正确?___________(填“正确”或“不正确”)。
(3)为研究该反应是吸热还是放热反应,某研究小组以《NaHCO3、Na2CO3 和盐酸反应过程中热效应的研究》为研究课题,进行了如下实验(每次实验各做三次,取平均值):
|
序号 |
试剂1 |
试剂2 |
混合前温度 |
混合后最高 或最低温度 |
|
① |
35mL水 |
2.5g NaHCO3固体 |
20℃ |
18.5℃ |
|
② |
35mL水 |
3.2 Na2CO3固体 |
20℃ |
24.3℃ |
|
③ |
35mL稀盐酸 |
含2.5g NaHCO3的饱和溶液32.5mL |
20℃ |
19℃ |
|
④ |
35mL稀盐酸 |
含3.2g Na2CO3的饱和溶液23.1mL+10ml水 |
20℃ |
24.2℃ |
|
⑤ |
35mL稀盐酸 |
2.5gNaHCO3固体 |
20℃ |
16.2℃ |
|
⑥ |
35mL稀盐酸 |
3.2g Na2CO3固体 |
20℃ |
25.1℃ |
请你帮助填写相关内容:
该实验中所用的仪器除试管、药匙(或V型纸槽)、气球、玻璃棒、烧杯、量筒、保温瓶外,还需要的仪器名称为______________和_______________;
(4)通过上述实验可以得出_____________(填字母编号)。
A、NaHCO3的溶解是吸热过程
B、NaHCO3的饱和溶液和盐酸的反应是吸热反应
C、Na2CO3的溶解是放热过程
D、Na2CO3的饱和溶液和盐酸的反应是吸热反应
(5)结论:影响NaHCO3固体与稀盐酸反应的反应热因素有________________________________________________________________________。
20、(10分)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e-=NO+2H2O ;
KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:
(2)反应中硝酸体现了 、 性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是 mol。
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是:
(5)KMnO4在酸性溶液中发生还原反应的反应式:
19、(12分)写出下列反应的离子方程式
(1)向溴化亚铁溶液中加入足量氯水:
____________________________________________________,
(2)向FeCl3溶液中加入过量的硫化钠:
____________________________________________________,
(3)向硫酸铝KAl(SO4) 2溶液中加入Ba(OH)2 使沉淀的质量最大:
____________________________________________________,
(4)向CuSO4溶液中加入金属钠:
____________________________________________________,
(5)向NaHCO3溶液中滴入少量的氢氧化钙溶液:
____________________________________________________,
(6)向CuSO4溶液中通入硫化氢:
____________________________________________________。
18.下列反应的离子方程式正确的是
A.铜片插入氯化铁溶液中 Cu+Fe3+=Cu2++Fe2+
B.电解饱和食盐水 2Cl-+2H+ H2↑+C12↑
H2↑+C12↑
C.碳酸钙与盐酸反应 CaCO3+2H+ = Ca2++CO2↑ +H2O
 D.向硫酸铝铵[NH4Al(SO4)2]溶液中滴加足量Ba(OH)2溶液
D.向硫酸铝铵[NH4Al(SO4)2]溶液中滴加足量Ba(OH)2溶液
NH4++Al3++2SO42-+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3·H2O+2H2O
第II卷(共52分)
17.下图是几种盐的溶解度曲线,下列说法中正确的是
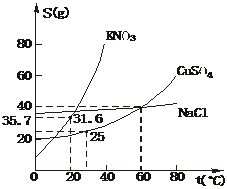
A.40℃时,将35 g食盐溶于100 g水中,降温至0℃时,可析出NaCl晶体
B.20℃时KNO3饱和溶液的溶质质量分数为31.6%
C.60℃时,200 g水中溶解80 g CuSO4达饱和,当降温至30℃时,可析出30 g硫酸铜晶体
D.30℃时,将35 g KNO3和35 g NaCl同时溶于100 g水中,蒸发时先析出的晶体是NaCl
16.自然界中存在一种尖晶石,化学式可表示为MgAl2O4,它透明色美,可作为宝石。已知该尖晶石中混有Fe2O3。取一定量样品5.4g,恰好完全溶解在一定浓度100 mL盐酸溶液中,盐酸浓度可能是
A.2.8 mol·L-1 B.3.8 mol·L-1
C.4.3 mol·L-1 D.4.9 mol·L-1
15.向一定量的Fe、FeO和Fe2O3的混合物中加入120mL 4mol/L的稀硝酸,恰好使混合物完全溶解,放出1.344L NO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现。若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为
A.0.24mol B.0.21mol C.0.16mol D.0.14mol
14.多硫化钠Na2Sx(x≥2)在结构上与Na2O2,FeS2等有相似之处,Na2Sx在碱性溶液中可被NaClO氧化成Na2SO4,而NaClO被还原成NaCl,反应中Na2Sx与NaClO的量之比为1:16,则x值是
A.5 B.4 C.3 D.2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com