
1、① 2MnO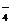 +5SO
+5SO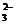 +6H+==2Mn2++5SO
+6H+==2Mn2++5SO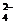 +3H2O;
+3H2O;
② Cl2+H2O+SO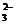 ==SO
==SO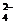 +2H++2Cl-
+2H++2Cl-
(3)在确定溶液中不含Ag+等干扰离子存在时可选用盐酸酸化的BaCl2溶液作试剂检验SO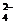 ,在确定溶液中不含SO
,在确定溶液中不含SO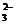 等干扰离子存在时可选用HNO3酸化的Ba(NO3)2溶液作试剂检验SO
等干扰离子存在时可选用HNO3酸化的Ba(NO3)2溶液作试剂检验SO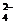 解析:考察离子的鉴定。
解析:考察离子的鉴定。
7.一种白色晶体A极易溶于水,将A配成溶液进行如下框图所示的实验,实验现象及转化关系如下列框图所示。
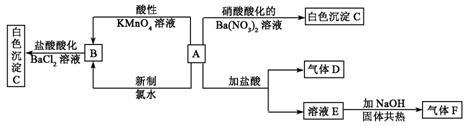
其中A为正盐,气体D能使品红溶液褪色,气体F能使湿润的红色石蕊试纸变蓝。试回答下列问题:
(1)写出下列物质化学式:A:______;C:____;
(2)写出下列反应的离子方程式:
① A和酸性KMnO4溶液:____________。
② A和新制氯水:________。
(3)通过本题的解答在检验SO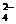 时是使用HCl酸化的BaCl2溶液还是使用硝酸酸化的Ba(NO3)2,你得到的启示是:__________。
时是使用HCl酸化的BaCl2溶液还是使用硝酸酸化的Ba(NO3)2,你得到的启示是:__________。
[答案](1)(NH4)2SO3;BaSO4;
6. A-I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含同一种元素在周期表中位置______。
(2)写出C、G物质的化学式。C_____ G____
(3)写出①、④、⑥反应的化学方程式:
反应①:________反应④:__________反应⑥:__________
(4)从能量变化的角度看,①②③反应中属于△H<0的反应是____(填序号)
[答案](1)第四周期、第Ⅷ族;(2)FeCl2 Al2O3;(3)8Al+3Fe3O4 4Al2O3+9Fe;2Al+2OH-+2H2O=2AlO2-+3H2↑;4Fe(OH)2+O2+2H2O=4Fe(OH)3;(4)①②
4Al2O3+9Fe;2Al+2OH-+2H2O=2AlO2-+3H2↑;4Fe(OH)2+O2+2H2O=4Fe(OH)3;(4)①②
[解析]考察电解知识和金属知识的整合。
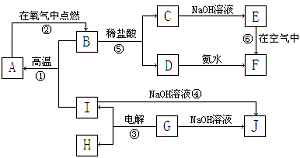
5.下图表示各物质之间的转化关系。已知:常温下D、E、F、I、J为气体,且D、I是水煤气的主要成分;B是无色液体,M为红褐色固体,C的焰色反应为黄色。
(1)基于反应①原理的化学工业称为 ,写出该反应的化学方程式 。
(2)写出K和E反应的离子方程式_____。写出F溶液和H反应的离子方程式_______。
(3)已知:由G分解得到的H、I、J三者的物质的量之比为1∶1∶1,则G的化学式为____。
[答案](1)氯碱工业;2NaCl+2H2O H2↑+C12↑+2NaOH;(2)2Fe2++Cl2=2Fe3++2Cl-;FeO+2H+=Fe2++H2O(3)FeC2O4
H2↑+C12↑+2NaOH;(2)2Fe2++Cl2=2Fe3++2Cl-;FeO+2H+=Fe2++H2O(3)FeC2O4
[解析]考察无机推断和定量计算相结合。
4.有一固体X它由两种常见元素组成,其中金属元素与另一元素的质量比为14:1。在一定条件下X可发生下列转化,有的反应标出全部产物,有的反应标出部分产物。P为混合物气体,R是无色无味能使澄清石灰水变浑浊的气体。C为红褐色物质,M为常见金属单质。试填空:
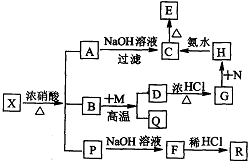
(1)X的化学式为 。(2)N应选择下列物质中的_____(填序号)
a. KMnO4 b. HNO3 c. H2O2 d. C12
(3)写出反应的离子方程式:
D→G ;
H→C 。
(4)B+M反应的化学方程式: 。
答案:(1)Fe3C;(2)c d;(3)Fe3O4十8H+==Fe2++2Fe3++4H2O;
Fe3++3NH3·H2O==Fe(OH)3↓++3NH4+
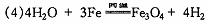
3.下图表示各物质之间的转化关系。已知:A、D、F、H均为单质,X常温下为无色液体,B为淡黄色固体,J溶于酸得到黄色溶液。请按要求填空:
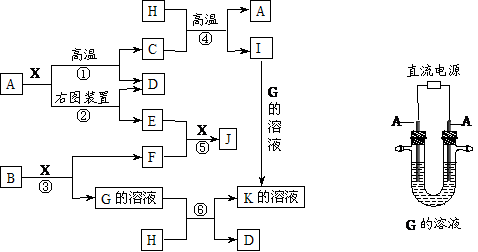
(1)写出B的电子式:_________。
(2)写出生成E的电极反应式:_________,反应⑤的现象是_______。
(3)反应①的化学方程式是______,在实验室中引发反应④的操作是_____。
(4)反应⑥的离子方程式是__________。
[答案](1)Na+[ ]2-Na+ ;(2)Fe+2OH――2e-=Fe(OH)2;白色物质迅速转变为灰绿色最终变为红褐色;(3)3Fe+4H2O(g)
]2-Na+ ;(2)Fe+2OH――2e-=Fe(OH)2;白色物质迅速转变为灰绿色最终变为红褐色;(3)3Fe+4H2O(g) Fe3O4+4H2;加少量KClO3,插上镁条并将其点燃;(4)2Al+2OH-+2H2O=2AlO2-+3H2↑
Fe3O4+4H2;加少量KClO3,插上镁条并将其点燃;(4)2Al+2OH-+2H2O=2AlO2-+3H2↑
[解析]考察各元素性质的综合推断。
2.已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质)。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图:(注意:其中有些反应的条件及部分生成物被略去)请填写下列空白:
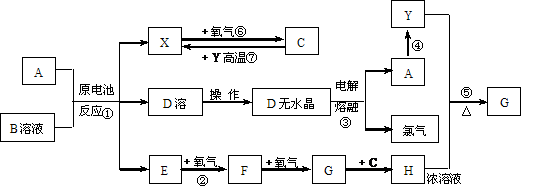
(1)反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为: 。
(2)从D溶液制备D的无水晶体的“操作a”为 。
(3)反应②的化学方程式为 。
(4)反应⑤的化学方程式为_____________。
(5)原电池反应①中正极的电极反应式为 。
答案:(1)2Mg+CO2 2MgO+C;(2)将D溶液在HCl气流中蒸干;
2MgO+C;(2)将D溶液在HCl气流中蒸干;
(3)② 4NH3+5O2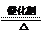 4NO+6H2O;(4)⑤ C+4HNO3(浓)
4NO+6H2O;(4)⑤ C+4HNO3(浓) CO2+4NO2↑+2H2O
CO2+4NO2↑+2H2O
(5)2NH4++2e-=2NH3↑+H2↑
无机推断题涉及到的知识面很广,涉及到的知识包括元素化合物、物质结构、计算、实验以及与生活环境、工业生产等,是一种综合性很强的题目,解决这类题目最好的办法是立足于酸、碱、盐、单质、氧化物间的基本转化关系,有意识地跨越中学各知识板块云展开思考。所幸的是一般涉及的物质基本都是教材中常见的物质,这也是一条思考的线索。
例14.下图中各方框中的字母表示有关的一种反应物或生成物(某些物质略去)其中常温下B、D、G、I、J为气体,其中B可使湿润的红色石蕊试纸变蓝,A-N的所有物质中只有G为单质,其余为化合物。N为不溶于水的无机酸。
回答下列问题:
(1)A的名称为 ,F的化学式是 ;
H的化学式是 ,L的化学式是
(2)写出实验室制取I的离子方程式:
(3)写出G的一种同素异形体的化学式: 该物质与G在化学性质上的共同点是 。
(4)已知工业上生产0.1molB放出4.62kj热量,写出该反应的热化学方程式:
(5)在反应C+E→G+F中,每生成1molG转移 mol电子。


 [解析]B为可使湿润的红色石蕊试纸变蓝的气体,故B为NH3;N为不溶于水的无机酸,应为H2SiO3(或H2SiO4);根据B+GI, I +G J,G为气体单质,B为NH3,可以判断G应为O2,I为NO,J为NO2;化合物E与C、D反应都能产生O2,则E为Na2O2;C、D分别为CO2和H2O,F、H分别为NaOH、Na2CO3;由J(NO2)+C K,故C应为H2O,K为HNO3;M可由NaOH或Na2与L反应得到,M与K(HNO3)反应生成HSiO3(或H4SiO4),故M为H2SiO3,L为SiO2由L+H M可确定H为Na2CO3,因此F为NaOH,C为H2O,D为CO2。最后由A NH3+H2O+ CO2,可以确定A为NH4HCO3或(NH4)2CO3.
[解析]B为可使湿润的红色石蕊试纸变蓝的气体,故B为NH3;N为不溶于水的无机酸,应为H2SiO3(或H2SiO4);根据B+GI, I +G J,G为气体单质,B为NH3,可以判断G应为O2,I为NO,J为NO2;化合物E与C、D反应都能产生O2,则E为Na2O2;C、D分别为CO2和H2O,F、H分别为NaOH、Na2CO3;由J(NO2)+C K,故C应为H2O,K为HNO3;M可由NaOH或Na2与L反应得到,M与K(HNO3)反应生成HSiO3(或H4SiO4),故M为H2SiO3,L为SiO2由L+H M可确定H为Na2CO3,因此F为NaOH,C为H2O,D为CO2。最后由A NH3+H2O+ CO2,可以确定A为NH4HCO3或(NH4)2CO3.

 [答案](1)碳酸铵或碳酸氢铵;NaOH;Na2CO3;SiO2
[答案](1)碳酸铵或碳酸氢铵;NaOH;Na2CO3;SiO2
 (2)3Cu+8H++2NO3- 3Cu2++2NO↑+4H2O
(2)3Cu+8H++2NO3- 3Cu2++2NO↑+4H2O
(3)O3; 具有氧化性
 (4)N2(g)+3H2(g) 2NH3(g); △H=-92.4k J·mol-1
(4)N2(g)+3H2(g) 2NH3(g); △H=-92.4k J·mol-1
(5)2
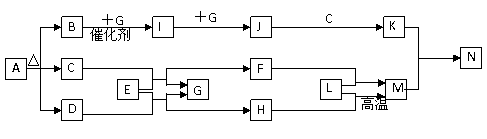
例15.利用天然气合成氨的工艺流程示意图如下:
依据上述流程,完成下列填空:
⑴图中CH4的第一次转化过程中的化学方程式是__________________。
⑵脱硫过程中,若有n mol Fe2O3·H2O转化,则生成S的物质的量为 mol(用含n的代数式表示)。
⑶整个流程有三个循环:一是K2CO3(aq)循环,二是N2和H2循环,第三个循环中被循环物质是____________。
⑷改用过量NaOH溶液吸收天然气中的硫化氢,以石墨作电极电解吸收后所得溶液可回收硫,其电解总反应方程式(忽略氧气的氧化还原)为____________________,该方法的优点是____________。
[解析]该生产工艺属于多处循环生产工艺,因此分析工艺流程示意图时,分析的主线是弄清基本原材料CH4转化为合成氨的基本原料N2和H2的工艺生产原理。但还要回头分析循环生产的理由和循环生产的工艺生产段。通过这样既考虑产品的合成,又考虑原料的充分利用,该题所涉及到的问题也就可以解答了。
[答案](1)CH4+H2O CO+3H2;(2)n ;(3)Fe2O3·H2O;(4)Na2S+2H2O2NaOH+S+H2↑,NaOH可以循环利用,同时获得副产品氢气。(优点答到“NaOH可以循环利用”即可)
CO+3H2;(2)n ;(3)Fe2O3·H2O;(4)Na2S+2H2O2NaOH+S+H2↑,NaOH可以循环利用,同时获得副产品氢气。(优点答到“NaOH可以循环利用”即可)
例16.(2009年全国一卷)已知周期表中,元素Q、R、W、Y与元素X相邻。Y的最高化合价氧化物的水化物是强酸。回答下列问题:
(1)W与Q可以形成一种高温结构陶瓷材料。W的氯化物分子呈正四面体结构,W的氧化物的晶体类型是 ;
(2)Q的具有相同化合价且可以相互转变的氧化物是 ;
(3)R和Y形成的二元化合物中,R呈现最高化合价的化合物的化学式是 ;
(4)这5个元素的氢化物分子中,①立体结构类型相同的氢化物的沸点从高到低排列次序是(填化学式) ,其原因是
;
②电子总数相同的氢化物的化学式和立体结构分别是
;
(5)W和Q所形成的结构陶瓷材料的一种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCL气体;W(QH2)4在高温下分解生成Q的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是 。
 [解析]本题可结合问题作答。W的氯化物为正四体型,则应为SiCl4或CCl4,又W与Q形成高温陶瓷,故可推断W为Si。(1)SiO2为原子晶体。(2)高温陶瓷可联想到Si3N4,Q为N,则有NO2与N2O4之间的相互转化关系。(3)Y的最高价氧化的的水化物为强酸,且与Si、N等相邻,则只能是S。R为As,所以R的最高价化合物应为As2S5。(4)显然x为P元素。①氢化物沸点顺序为NH3> AsH3
> PH3,因为前者中含有氢键后两者构型相同,分子间作用力不同。②SiH4、PH3和H2S的电子数均为18。,结构分别为正四面体,三角锥和V形。(5)由题中所给出的含字母的化学式可以写出具体的物质,然后配平即可。
[解析]本题可结合问题作答。W的氯化物为正四体型,则应为SiCl4或CCl4,又W与Q形成高温陶瓷,故可推断W为Si。(1)SiO2为原子晶体。(2)高温陶瓷可联想到Si3N4,Q为N,则有NO2与N2O4之间的相互转化关系。(3)Y的最高价氧化的的水化物为强酸,且与Si、N等相邻,则只能是S。R为As,所以R的最高价化合物应为As2S5。(4)显然x为P元素。①氢化物沸点顺序为NH3> AsH3
> PH3,因为前者中含有氢键后两者构型相同,分子间作用力不同。②SiH4、PH3和H2S的电子数均为18。,结构分别为正四面体,三角锥和V形。(5)由题中所给出的含字母的化学式可以写出具体的物质,然后配平即可。
[答案](1)原子晶体。(2)NO2和N2O4(3)As2S5。(4)①NH3> AsH3 > PH3,因为前者中含有氢键,后两者构型相同,分子间作用力不同;②电子数相同的有SiH4、PH3和H2S结构分别为正四面体,三角锥和V形。(5)SiCl4 + 4NH3 = Si(NH2)4 + 4HCl,3Si(NH2)4 = 8NH3 + Si3N4
[专题突破]
1. 有A、B、C、D四种短周期的非金属元素(其单质也可分别用A、B、C、D表示),四种元素的原子序数按B、D、C、A顺序增大,D、C元素在周期表中位置相邻。在一定条件下,B可以分别和A、C、D化合生成甲、乙、丙化合物,C和D化合可得丁。已知乙、丙两个分子中各含有10个电子,并且甲、乙、丙、丁、戊有如下的变化关系:
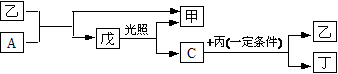
请填写下列空格:
(1)甲的浓溶液与一种黑色粉末共热可得A,工业上保存A的方法为:_____。
(2)写出下列化学用语:
用电子式表示乙分子的形成过程_____________,
戊分子的结构式是____________,
甲和丙反应产物的电子式 _______________。
(3)写出下列反应的化学方程式:
丙+丁→D + 乙:_______________
A+丙→D + 甲:________________
[答案](1)干燥后加压液化贮存于钢瓶中
(2) H-O-Cl
H-O-Cl
(3)4NH3+6NO 5N2+6H2O;2NH3+3Cl2=6HCl+N2
5N2+6H2O;2NH3+3Cl2=6HCl+N2
例12.聚合氯化铝是一种新型、高效絮凝剂和净水剂,其单体是液态的碱式氯化铝[Al2(OH)nCl6-n]。
本实验采用铝盐溶液水解絮凝法制备碱式氯化铝。其制备原料为分布广、价格廉的高岭土,化学组成为:Al2O3(25%-34%)、SiO2(40%-50%)、Fe2O3(0.5%-3.0%)以及少量杂质和水分。已知氧化铝有多种不同的结构,化学性质也有差异,且一定条件下可相互转化;高岭土中的氧化铝难溶于酸。制备碱式氯化铝的实验流程如下:
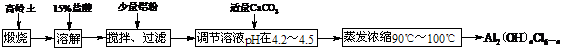
根据流程图回答下列问题:
⑴“煅烧”的目的是___________________________________________________________。
⑵配制质量分数15%的盐酸需要200 mL 30%的浓盐酸(密度约为1.15 g·cm-3)和_______ g蒸馏水,配制用到的仪器有烧杯、玻璃棒、______________。
⑶“溶解”过程中发生反应的离子方程式为____________________________________________。
⑷加少量铝粉的主要作用是_____________________________________。
⑸“调节溶液pH在4.2-4.5”的过程中,除添加必要的试剂,还需借助的实验用品是_________________;“蒸发浓缩”需保持温度在90-100℃,控制温度的实验方法是_________________。
[解析]对比原料与产品可知,该生产的主要工序:一是除去原料高岭土中的杂质,二是将Al2O3利用水解絮凝法转化为产品。再进一步分析,除铁用铝置换后过滤,高岭土中的Al2O3不溶于酸,必须经煅烧改变结构。该题经这样分析,题设的所有问题的答案就在分析之中。
[答案]⑴改变高岭土的结构,使其能溶于酸;⑵230;量筒;⑶Al2O3+6H+=2Al3++3H2O Fe2O3+6H+=2Fe3++3H2O;⑷除去溶液中的铁离子;⑸pH计(或精密pH试纸);水浴加热
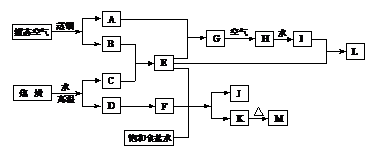 例13.某化工厂的生产流程如右图:
例13.某化工厂的生产流程如右图:
⑴L、M的名称分别是___________、___________。
⑵G→H过程中为什么通入过量空气_________________________________。
⑶用电子式表示J_______________。
⑷写出饱和食盐水、E、F生成J和K(此条件下K为沉淀)的化学方程式:
_________________________________,要实现该反应,你认为应该如何操作______________________________。
[解析]根据流程示意图分析可知,用空气、焦炭和水为原材料,最终生产L和J、M的产品,首先必须生产中间产品E。这样,主要生产流水线至少有两条(液态空气-E-M;焦炭-E-L)。为了弄清该化工生产的生产工艺,须将这两条生产流水线交叉综合分析,最终解答题设的有关问题。
[答案]⑴硝酸铵;碳酸钠;
⑵提高NO的转化率使NO充分反应NO2的同时,还有氧气剩余,还可再与NO2与水反应的产物NO反应即 4NO+3O2+2H2O=4HNO3;
⑶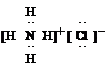 ;
;
⑷ NaCl(饱和)+NH3+CO2=NaHCO3↓+NH4Cl 在饱和食盐水溶液中通入足量的氨气后,再通入足量的二氧化碳气体,并将反应的装置放在冰水中冷却,即可获得碳酸氢钠结晶。
知识准备:近两年计算型推断题成为高考热点之一,解这类题时要善于抓住物质转化时相对分子质量的变化(例CO→CO2,NO → NO2,SO2→SO3转化时分子中都增加1个氧原子,相对分子质量变化均为16 );放出气体的体积或生成沉淀的量;化合物中各元素的含量;气体的相对密度;相对分子质量;离子化合物中离子个数比;反应物之间的物质的量比;电子总数;质子总数等重要数据。
例10. 已知甲、乙、丙为常见单质,A、B、C、D、E、F、G、X均为常见的化合物;B和X的摩尔质量相同,E的相对分子质量比D的相对分子质量大16,在一定条件下,各物质相互转化关系如下图所示:

(1)写出X的电子式和G的化学式:X__________,G__________;
(2)写出有关变化的化学方程式:
B+H2O:____________;
D+丙:_____________。
[解析]单质甲、乙均能分别与单质丙连续两次反应,可能是单质甲、乙分别被O2连续两次氧化,生成不同的氧化物,则丙是O2。氧化物B与水反应能放出O2,则B是Na2O2,那么C是NaOH,A是Na2O,甲是Na。又因B和X的摩尔质量相同,则X是Na2S,那么乙是S,F是SO2,G是SO3。进一步推出D是Na2SO3,E是Na2SO4,而Na2SO4的相对分子质量比Na2SO3的相对分子质量大16,符合题意。
[答案](1) Na+[: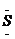 :]2-Na+;SO3(2)2Na2O2+2H2O=4NaOH+O2;2Na2SO3+O2=2Na2SO4
:]2-Na+;SO3(2)2Na2O2+2H2O=4NaOH+O2;2Na2SO3+O2=2Na2SO4
例11. A-J是中学化学教材中常见的物质,A-J有如下转化关系,J是不溶于水的白色固体,且其相对分子质量为100。则(1)A的化学式是____,J的化学式是_____。(2)B和E反应的化学方程式是_______。
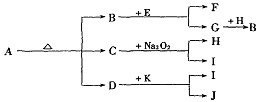
解析:J是不溶于水的白色固体,且其相对分子质量为100,可知J是CaCO3。D与K反应生成I和J,可知D与CaCO3含有相同的离子或元素。C能与Na2O2反应生成H,还有和D与K反应相同的产物I,可知C是CO2或H2O,I不可能是O2,H应是O2。因G和H反应生成B,则B可能是一种氧化物。A受热分解生成B、C和D,结合以上对B、C和D的分析,可知A是NaHCO3,则B是CO2,C是H2O,D是Na2CO3。进一步推出E是Mg,F是MgO,G是单质碳,I是NaOH。
答案(1)NaHCO3,CaCO3 (2)2Mg+CO2======2MgO+C
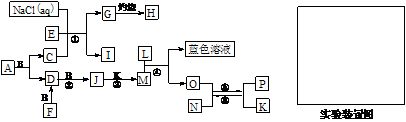 例12.已知A是一种有机溶剂,F 是一种黄色晶体,N带有磁性,B、F、L、O、P是中学化学常见单质,J的相对分子质量比D大16,A和B反应前后气体体积(常温常压)保持不变,在试管中灼烧固体I,试管底部无固体残留,反应①②③均是化工生产中的重要反应。
例12.已知A是一种有机溶剂,F 是一种黄色晶体,N带有磁性,B、F、L、O、P是中学化学常见单质,J的相对分子质量比D大16,A和B反应前后气体体积(常温常压)保持不变,在试管中灼烧固体I,试管底部无固体残留,反应①②③均是化工生产中的重要反应。
⑴A的结构式___________。
⑵写出反应①的化学方程式_________________________________。
⑶高温下反应⑤⑥互为可逆反应,写出反应⑥的化学方程式_________________________________,该反应的平衡常数表达式K=_______。
⑷请设计一个实验方案,完成反应④,并在答题卡指定位置绘出实验装置图。
⑴ S=C=S;⑵ NaCl+CO2+H2O+NH3=NaHCO3↓+NH4Cl;⑶ 3Fe+4H2O(g) Fe3O4+4H2 K=
Fe3O4+4H2 K=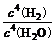 ;⑷
;⑷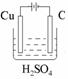
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com