
24.(7分)有如下规律可判断元素原子的失电子能力:比较元素的单质与水(或非氧化性酸)反应置换出氢气的难易程度。置换反应越容易发生,元素原子失电子能力越强。某化学活动小组为了验证上述规律设计了以下实验进行探究,请你填写下表有关内容:
|
实验内容 |
实验现象 |
实验结论 |
|
(1)Na、Mg(条)、K与水反应 |
|
同一周期自左而右元素原子失电子的能力逐渐
;同一主族自上而下元素原子失电子能力依次 。 |
|
(2)Mg、Al与酸反应 |
|
23. (10分)某课外实验小组利用稀硫酸与金属铁反应探究影响化学反应速率的因素,得到如下实验数据:
|
实验 序号 |
铁的 质量/g |
铁的 形态 |
c/(H2SO4) /mol·L-1 |
V(H2SO4) /mL |
溶液温度/℃ |
金属消失 的时间/s |
|
|
反应前 |
反应后 |
||||||
|
1 |
0.10 |
铁片 |
0.7 |
50 |
20 |
36 |
250 |
|
2 |
0.10 |
铁片 |
0.8 |
50 |
20 |
35 |
200 |
|
3 |
0.10 |
铁粉 |
0.8 |
50 |
20 |
36 |
25 |
|
4 |
0.10 |
铁片 |
1.0 |
50 |
20 |
35 |
125 |
|
5 |
0.10 |
铁片 |
1.0 |
50 |
35 |
50 |
50 |
分析上述数据,回答下列问题:
(1)实验2和3表明, 对反应速率有影响,影响规律是
;
(2)仅表明反应物浓度对反应速率产生影响的实验有 (填实验序号);
(3)本实验中影响反应速率的其他因素还有 ,能体现该影响因素的实验序号是 ;
(4)在实验4中滴入几滴硫酸铜溶液,金属消失的时间小于125s。
原因是
;
(5)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,试从反应过程能量的变化角度推测其原因
。
22. (5分)A是化学实验室中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平。有关物质的转化关系如下图所示:
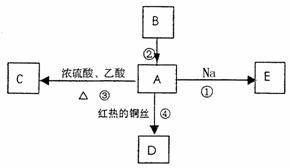
(1)写出B物质的结构简式 ;
(2)反应④的化学方程式 ;
(3)反应②、③的反应类型分别为 、 。
21.(8分)根据元素周期表1-20号元素的性质和递变规律,请回答下列问题:
(1)属于金属元素的有 种,失电子能力最强的元素是 (填元素符号);
(2)形成化合物种类最多的两种元素是 (填元素符号);
(3)第三周期中,原子半径最大的元素的单质(稀有气体除外)与氧气反应生成的所有化合物的化学式为 ;
(4)推测P、O元素最简单气态氢化物的稳定性较强的是 (填化学式);
(5)第ⅢA族某元素最高价氧化物对应水化物呈两性,该水化物与烧碱溶液反应的离子方程式为 。
20. 下列叙述合理的是
A. 汽油、柴油和植物油都是碳氢化合物
B. 棉、麻、丝、毛及合成纤维完全燃烧都只生成CO2和H2O
C. 水电站把机械能转化成电能,而核电站是把化学能转化成电能
D. 我国规定自2008年6月1日起,商家不得无偿提供塑料袋,目的是减少“白色污染”
第Ⅱ卷(非选择题 共50分)
19. 已知短周期元素的离子aA2+、bB+、cC2-、dD-具有相同的电子层结构。则下列叙述正确的是
A. 原子半径 A>B>C>D
B. 离子半径 C2->D->B+>A2+
C. 原子序数 d>c>b>a
D. 原子的失电子能力 A>B>D>C
18. 下列化学方程式书写不正确的是
A. CH4+Cl2 CH3Cl+HCl
B. 2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
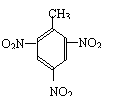

C. +3HNO3
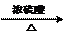
D. CH3COOCH2CH3+NaOH→CH3COONa+CH3CH2OH
17. 假设某化学反应的反应过程如下图表示:
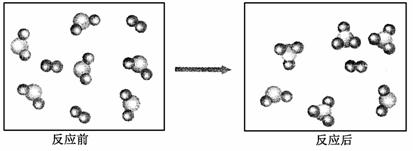
观察分析,符合图中变化的化学反应为
A. A2+3B2 2AB3 B. 2AB2+B2 2AB3
C. 2A2B+5B2===4AB3 D. 2AB2+B2===2AB3
16. 在一定条件下,可逆反应A(g)+B(g) 2C(g)一定达到平衡的标志是
A. B的生成速率与A的消耗速率相等
B. 体系的质量不再发生变化
C. A、B、C的浓度之比为1∶1∶2
D. 每消耗1molA同时生成2molC
15. 使1mol乙烯与氯气发生完全加成反应,然后使该加成反应的产物与氯气在光照的条件下发生取代反应,则两个过程中消耗氯气的总物质的量最多是
A. 3mol B. 4mol C. 5mol D. 6mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com