
20.(10分)下表是某食用碘盐包装袋上的部分说明:
|
配 料 |
食盐、碘酸钾、抗结剂 |
|
碘含量 |
35±15mg/kg |
|
储藏方法 |
密封、避光、防潮 |
|
食用方法 |
烹饪时,待食品熟后加入碘盐 |
(1)下列说法正确的是
A.高温会导致碘的损失
B.碘酸钾可氧化氯化钠
C.只用淀粉就能检验碘盐中的碘酸钾
D.该碘盐中碘酸钾含量为20~50mg/kg
|
在一定条件下电解,反应的方程式为KI + 3H2O KIO3 + 3H2↑。则阳极电极反
应式为
(3)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式,并标出电子转移的方向和数目。
KIO3+ KI+ H2SO4= K2SO4+ I2+ H2O
该反应的氧化剂为
(4)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用碘盐中碘的含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液
19.(8分)“绿色试剂”双氧水可作为矿业废液消毒剂,如消除采矿业废液中的氰化物(如KCN),反应的化学方程式为;KCN+H2O2+H2O=A+NH3↑
回答下列问题:
(1)生成物A的化学式为____________。
(2)在标准状况下有0.448 L氨气生成,则转移的电子数为____________。
(3)反应中被氧化的元素为____________。
(4)H2O2被称为“绿色氧化剂”的理由是 。
18.(12分)熟悉和使用中学化学实验中常见仪器及用品,是化学学习的基本要求。试回答以下问题:
(1) 在仪器:a.分液漏斗 b.试剂瓶 c.集气瓶 d.滴定管 e.容量瓶 f.量筒
g.托盘天平中,标有“0”刻度的是(填序号) 。
(2)“磨砂”是增加玻璃仪器密封性的一种处理工艺。在下列仪器中,没有用到 “磨砂”工艺处理的有(填序号) 。
a、试管 b.分液漏斗 c.带滴管的试剂瓶(滴瓶)
d.集气瓶 e.酸式滴定管 f.碱式滴定管,
(3) 用装置甲、乙、丙和乳胶管组成一套装置(气密性已检查),可用于制取并收集
NH3或HCl气体。可供选择的液体试剂有:浓硫酸、浓盐酸、浓氨水,丙中试剂为
紫色石蕊溶液。请回答下列问题:
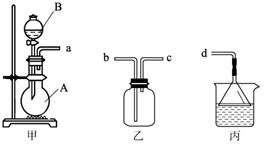
① 若制取某气体的过程中,丙中的石蕊溶液变红,且烧瓶中的试剂A与分液漏斗中的试剂B均为无色液体,则试剂A为 ,制取该气体利用了B的性质有 、 。
通过丙中紫色石蕊溶液变红或变蓝,说明乙中气体已集满。若石蕊溶液变蓝,则烧
瓶甲中应加入的固体试剂A为 ;
② 若在乙中收集氨气,气体流经装置的顺序是:a→ → →d(填接口代
号)。
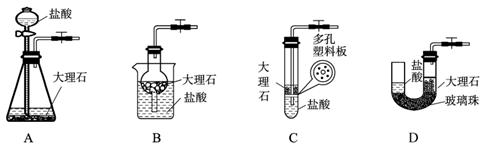
(4)下图中的装置D是实验室制备CO2的简易装置图,用该装置制备CO2可起到随时使反应发生,也可以随时使反应停止的效果。下图中的装置A、B、C也可起到相同效果的有 (填写编号)。
17.(10分)写出下列反应过程的离子方程式:
①在NaOH和NaAlO2溶液中滴加盐酸至过量
、 、
②在NaOH和Na2CO3的混合溶液中滴加盐酸至过量
、 、
③在Ba(OH)2溶液中通入过量、、SO2____________、___________________________
④在NH4HCO3溶液中加入足量Ba(OH)2溶液_______、_______________
16.锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水。当生成1 mol硝酸锌时,被还原的硝酸的物质的量为 ( )
A.2 mol B.1 mol C.0.5 mol D.0.25 mol
第Ⅱ卷 非选择题(共52分)
15.Na2FeO4是一种高效多功能水处理剂,应用前景广阔,一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,对此反应下列说法不正确的是 ( )
A.Na2O2在反应中既作氧化剂又作还原剂
B.O2是氧化产物
C.Na2FeO4既是氧化产物又是还原产物
D.2 mol FeSO4发生反应时,共有8 mol电子转移
14.X、Y、Z为三种单质。已知:Y能将Z从其化合物的水溶液中置换出来,而Z又能将X从其化合物中置换出来。由此可以推断下列说法中可能正确的是 ( )
①单质的氧化性:Y>Z>X; ②单质的还原性:Y>Z>X;
③对应离子的氧化性:X>Z>Y; ④对应离子的还原性:X>Z>Y
A.只有① B.只有②③ C.只有①④ D.①②③④
13.下列叙述中,正确的是 ( )
A.由X变成X2+的反应是氧化反应
B.含氧酸有氧化性,无氧酸则无氧化性
C.失电子难的原子获得电子的能力一定强
D.阳离子只有氧化性,阴离子只有还原性
12.在含有大量Ba2+和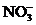 的溶液中,能大量共存的离子组 ( )
的溶液中,能大量共存的离子组 ( )
A.H+ K+ ClO- Cl- B.H+ NH4+ Fe2+ Br-
C.NH4+ K+ Cl- 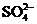 D.K+ Na+ Cl- OH-
D.K+ Na+ Cl- OH-
11.对下列反应①NaHCO3溶液与石灰水反应、②KAlO2溶液与稀盐酸反应、③Si与烧碱溶液反应、④Fe与稀硝酸反应,改变反应物用量,不能用同一个离子方程式表示的是( )
A.①②③ B.①②④ C.①③④ D.②③④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com