
366.某温度下,Na2CO3和NaHCO3溶解度分别是26.9g和10g。该温度下,取100g饱和Na2CO3溶液,向其中通入过量的CO2,可析出固体______g。
365、将足量的金属钠投入到100g t℃的水中,恰好得到t℃时111g NaOH的饱和溶液,则t℃时NaOH的溶解度是多少?
364、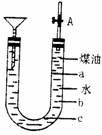 用如图的实验装置可以进行钠跟水的反应实验,并可收集、检验生成的气体。Na的的为0.97 g·cm-3,煤油的密度为0.87 g·cm-3。请回答下列问题。
用如图的实验装置可以进行钠跟水的反应实验,并可收集、检验生成的气体。Na的的为0.97 g·cm-3,煤油的密度为0.87 g·cm-3。请回答下列问题。
(1)液体物质添加完毕后,关闭活栓,打开右边胶塞,向煤油中加入一小块钠,立即塞好胶塞,反应开始前钠的位置在_________处(填a、b、c);
(2)反应后,钠在煤油层和水层界面之间上下跳动,反应平缓连续进行。试说明产生上述现象的原因:___________________________________________________________。
(3)写出Na跟水反应的离子方程式________________________________________。
(4)装置中的漏斗在反应过程中的主要作用是________________________________。
(5)本实验除能使反应平缓连续进行、收集并检验气体外,还有一个优点是_____________________,这是因为_____________________________________________。
363、
(1)NaHCO3与少量澄清石灰水反应的离子方程式:
________________________________________________________________
(2)NaHCO3与足量澄清石灰水反应的离子方程式:
________________________________________________________________
(3)写出超氧化钾与CO2反应的化学方程式:
_____________________________________________________________
362、已知Na2O2能与许多常见的气态非金属氧化物反应,如:
2Na2O2+CO2===2Na2CO3+O2
Na2O2+CO===Na2CO3
试分别写出Na2O2+SO2,Na2O2+SO3发生反应的化学方程式。
361、A、B、C都是含有同一元素的化合物,它们的焰色反应呈黄色,A与B作用生成C,对B加热可得C和无色气体D,D能使澄清石灰水变浑浊,D和C的水溶液发生反应生成B,当D和A反应时,由于反应物用量不同,既可生成B,也可生成C。
(1)写出A、B、C、D的化学式
A__________ B__________ C___________ D___________
(2)写出下列反应的离子方程式
①A+B→C
②D+C→B
③D+A→C
④D+A→B
7、电子在某处单位体积内出现的概率--电子云
课堂练习
(1)对玻尔理论的下列说法中,正确的是( ACD )
A.继承了卢瑟福的原子模型,但对原子能量和电子轨道引入了量子化假设
B.对经典电磁理论中关于“做加速运动的电荷要辐射电磁波”的观点表示赞同
C.用能量转化与守恒建立了原子发光频率与原子能量变化之间的定量关系
D.玻尔的两个公式是在他的理论基础上利用经典电磁理论和牛顿力学计算出来的
(2)下面关于玻尔理论的解释中,不正确的说法是( C )
A.原子只能处于一系列不连续的状态中,每个状态都对应一定的能量
B.原子中,虽然核外电子不断做加速运动,但只要能量状态不改变,就不会向外辐射能量
C.原子从一种定态跃迁到另一种定态时,一定要辐射一定频率的光子
D.原子的每一个能量状态都对应一个电子轨道,并且这些轨道是不连续的
(3)根据玻尔理论,氢原子中,量子数N越大,则下列说法中正确的是( ACD )
A.电子轨道半径越大 B.核外电子的速率越大
C.氢原子能级的能量越大 D.核外电子的电势能越大
(4)根据玻尔的原子理论,原子中电子绕核运动的半径( D )
A.可以取任意值 B.可以在某一范围内取任意值
C.可以取一系列不连续的任意值 D.是一系列不连续的特定值
(5)按照玻尔理论,一个氢原子中的电子从一半径为ra的圆轨道自发地直接跃迁到一半径为rb的圆轨道上,已知ra>rb,则在此过程中( C )
A.原子要发出一系列频率的光子 B.原子要吸收一系列频率的光子
C.原子要发出某一频率的光子 D.原子要吸收某一频率的光子
6、玻尔理论的局限性
玻尔理论虽然把量子理论引入原子领域,提出定态和跃迁概念,成功解释了氢原子光谱,但对多电子原子光谱无法解释,因为玻尔理论仍然以经典理论为基础。如粒子的观念和轨道。量子化条件的引进没有适当的理论解释。
4、玻尔理论对氢光谱的解释
(1)基态和激发态
基态:在正常状态下,原子处于最低能级,这时电子在离核最近的轨道上运动,这种定态,叫基态。
激发态:原子处于较高能级时,电子在离核较远的轨道上运动,这种定态,叫激发态。
(2)原子发光:原子从基态向激发态跃迁的过程是吸收能量的过程。原子从较高的激发态向较低的激发态或基态跃迁的过程,是辐射能量的过程,这个能量以光子的形式辐射出去,吸收或辐射的能量恰等于发生跃迁的两能级之差。
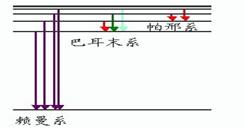
说明:氢原子中只有一个核外电子,这个电子在某个时刻只能在某个可能轨道上,或者说在某个时间内,由某轨道跃迁到另一轨道--可能情况只有一种。可是,通常容器盛有的氢气,总是千千万万个原子在一起,这些原子核外电子跃迁时,就会有各种情况出现了。但是这些跃迁不外乎是能级图中表示出来的那些情况。
(1)夫兰克-赫兹实验的历史背景及意义
1911年,卢瑟福根据α粒子散射实验,提出了原子核式结构模型。1913年,玻尔将普朗克量子假说运用到原子核式结构模型,建立了与经典理论相违背的两个重要概念:原子定态能级和能级跃迁概念。电子在能级之间跃迁时伴随电磁波的吸收和发射,电磁波频率的大小取决于原子所处两定态能级间的能量差。随着英国物理学家埃万斯对光谱的研究,玻尔理论被确立。但是任何重要的物理规律都必须得到至少两种独立的实验方法的验证。随后,在1914年,德国科学家夫兰克和他的助手赫兹采用电子与稀薄气体中原子碰撞的方法(与光谱研究相独立),简单而巧妙地直接证实了原子能级的存在,从而为玻尔原子理论提供了有力的证据。
1925年,由于他二人的卓越贡献,他们获得了当年的诺贝尔物理学奖(1926年于德国洛丁根补发)。夫兰克-赫兹实验至今仍是探索原子内部结构的主要手段之一。所以,在近代物理实验中,仍把它作为传统的经典实验。
(2)夫兰克-赫兹实验的理论基础
根据玻尔的原子理论,原子只能处于一系列不连续的稳定状态之中,其中每一种状态相应于一定的能量值En(n=1,2,3‥),这些能量值称为能级。最低能级所对应的状态称为基态,其它高能级所对应的态称为激发态。
当原子从一个稳定状态过渡到另一个稳定状态时就会吸收或辐射一定频率的电磁波,频率大小决定于原子所处两定态能级间的能量差。 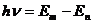 (h为普朗克恒量)
(h为普朗克恒量)
本实验中是利用一定能量的电子与原子碰撞交换能量而实现,并满足能量选择定则:
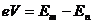 (V为激发电位)
(V为激发电位)
夫兰克-赫兹实验玻璃容器充以需测量的气体,本实验用的是汞。电子由阴级K发出,K与栅极G之间有加速电场,G与接收极A之间有减速电场。当电子在KG空间经过加速、碰撞后,进入KG空间时,能量足以冲过减速电场,就成为电流计的电流。
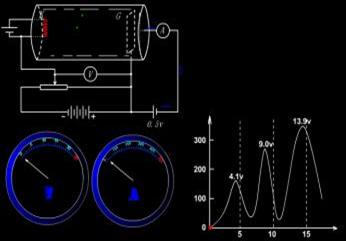
(3)实验原理
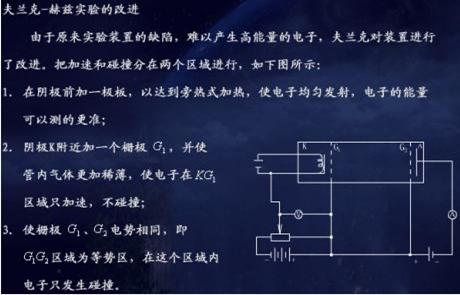
改进的夫兰克-赫兹管的基本结构如下图所示。电子由阴极K发出,阴极K和第一栅极G1之间的加速电压VG1K及与第二栅极G2之间的加速电压VG2K使电子加速。在板极A和第二栅极G2之间可设置减速电压VG2A。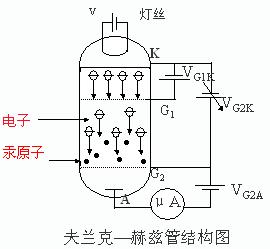
设汞原子的基态能量为E0,第一激发态的能量为E1,初速为零的电子在电位差为V的加速电场作用下,获得能量为eV,具有这种能量的电子与汞原子发生碰撞,当电子能量eV<E1-E0时,电子能量几乎不损失。如果eV≥E1-E0=ΔE,则汞原子从电子中取得能量ΔE,而由基态跃迁到第一激发态,ΔE=eVC。相应的电位差VC即为汞原子的第一激发电位。
在实验中,逐渐增加VG2K,由电流计读出板极电流IA,得到如下图所示的变化曲线:
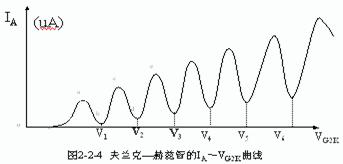
(4)实验结论
夫兰克-赫兹实验证明了原子被激发到不同的状态时,吸收的能量是不连续的,进而说明原子能量是量子化的。
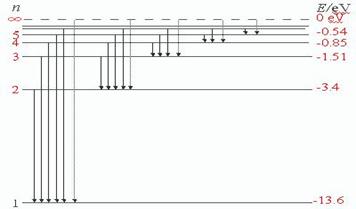
3、氢原子的能级图
从玻尔的基本假设出发,运用经典电磁学和经典力学的理论,可以计算氢原子中电子的可能轨道半径和相应的能量。
(1)氢原子的大小:氢原子的电子的各条可能轨道的半径rn: rn=n2r1,
r1代表第一条(离核最近的一条)可能轨道的半径 r1=0.53×10-10 m
例如:n=2, r2=2.12×10-10 m
(2)氢原子的能级:
原子在各个定态时的能量值En称为原子的能级。它对应电子在各条可能轨道上运动时的能量En(包括动能和势能) En=E1/n2 n=1,2,3,······
E1代表电子在第一条可能轨道上运动时的能量,E1=-13.6eV
注意:计算能量时取离核无限远处的电势能为零,电子带负电,在正电荷的场中为负值,电子的动能为电势能绝对值的一半,总能量为负值。
例如:n=2,E2=-3.4eV, n=3,E3=-1.51eV, n=4,E4=-0.85eV,……
氢原子的能级图如图所示:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com