
5.答案:D
解析:本题属信息迁移题。意在考查学生接受新信息、处理所给数据的能力。按题给数据代入v=k[c(H2)]m[c(Cl2)]n即可。第一组数据无法计算,代入第二组数据:2.0k=k(2.0)m(1.0)n,则m=1;代入第三组数据:4.0k=k(2.0)m(4.0)n,结合m=1,则n=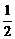 。故选D。
。故选D。
4.答案:AD
解析:NH3平均每秒钟的浓度变化,即v(NH3)=0.001 mol·L-1·s-1。其余根据同一反应用不同物质表示的反应速率之比等于方程式化学计量数之比可得出。
3.答案:C
解析: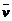 (H2O)=
(H2O)= 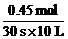 =0.0015
mol·L-1·s-1,则
=0.0015
mol·L-1·s-1,则
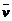 (NO)=0.0010
mol·L-1·s-1,
(NO)=0.0010
mol·L-1·s-1,
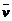 (NH3)=0.0010
mol·L-1·s-1,
(NH3)=0.0010
mol·L-1·s-1,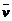 (O2)=0.00125 mol·L-1·s-1
(O2)=0.00125 mol·L-1·s-1
2.答案:B
解析:加热、发生原电池反应、增大固体反应物的表面积,都能加快反应速率;浓硫酸能使铁发生钝化,阻止了进一步的反应。
1.答案:C
解析:根据化学反应中速率比等于各物质的化学计量数之比,vA∶vB=1∶2,而vA=1 mol·
L-1·min-1,则vC=2 mol·L-1·min-1。
12.(1998年上海,26)智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘。
(1)试配平该反应的化学方程式,并用短线标出电子转移方向及总数。
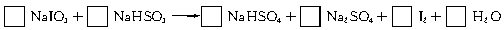
(2)已知含氧酸盐的氧化作用随溶液酸性的加强而增强,在制备实验时,定时取样,并用酸化的氯化钡来检测SO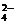 生成的量,发现开始阶段反应速率呈递增的趋势,试简述这一变化趋势发生的原因:
。
生成的量,发现开始阶段反应速率呈递增的趋势,试简述这一变化趋势发生的原因:
。
●答案解析
11.(2001年上海,24)某化学反应2A===B+D在四种不同条件下进行。B、D起始浓度为0。反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
根据上述数据,完成下列填空:
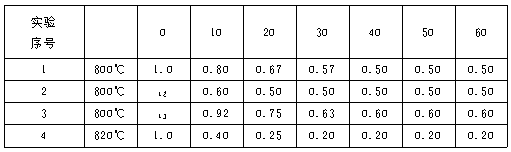
(1)在实验1,反应在10至20分钟时间内平均速率为 mol·(L·min)-1。
(2)在实验2,A的初始浓度c2=__________mol·L-1,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是__________。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3__________v1(填“>”“=”或“<”=,且c3__________1.0 mol·L-1(填“<”“=”或“>”)。
(4)比较实验4和实验1,可推测该反应是__________反应(填“吸热”或“放热”)。理由是 。
10.(2001年全国,21)在120℃时分别进行如下四个反应:
A.2H2S+O2===2H2O+2S B.2H2S+SO2===2H2O+2SO2
C.C2H4+SO2===2H2O+2CO2 D.C4H8+6O2===4H2O+4CO2
(1)若反应在容积固定的容器内进行,反应前后气体密度(d)和气体总压强(p)分别符合关系式d前=d后和p前>p后的是__________;符合关系式d前=d后和p前=p后的是__________;(请填写反应的代号)
(2)若反应在压强恒定容积可变的容器内进行,反应前后气体密度(d)和气体体积(V)分别符合关系式d前>d后和V前<V后的是__________,符合d前>d后和V前>V后的是__________。(请填写反应的代号)?
9.(1995年全国,19)反应4NH3+5O2 4NO+6H2O在5 L 密闭容器中进行,半分钟后,NO的物质的量增加了0.3 mol,则此反应的平均速率
4NO+6H2O在5 L 密闭容器中进行,半分钟后,NO的物质的量增加了0.3 mol,则此反应的平均速率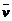 (X)(表示反应物的消耗速率或生成物的生成速率)为
(X)(表示反应物的消耗速率或生成物的生成速率)为
A.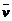 (O2)=0.01
mol·L-1·s-1
(O2)=0.01
mol·L-1·s-1
B.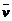 (NO)=0.008 mol·L-1·s-1
(NO)=0.008 mol·L-1·s-1
C.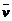 (H2O)=0.003
mol·L-1·s-1
(H2O)=0.003
mol·L-1·s-1
D.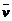 (NH3)=0.002
mol·L-1·s-1
(NH3)=0.002
mol·L-1·s-1
8.(1995年全国,13)在下列四种溶液中,加入少量固体二氧化锰,能生成气体的是
A.3%H2O2溶液 B.1 mol·L-1 NaOH溶液
C.1 mol·L-1 KClO3溶液 D.1 mol·L-1盐酸
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com