
1、有学者把文字的发明作为文明出现的标志之一。作为史料,下列所选取的一组甲骨文主要反映了中国古代的
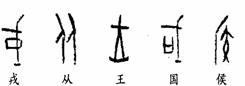
A.宗法制 B.分封制 C.郡县制 D.内外朝制
23. (12分)有一透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入一种淡黄色粉末状固体时,加热有刺激性气味的混合气体放出,同时生成白色沉淀。当加入0.4 mol淡黄色粉末时,产生气体0.3mol,继续加入淡黄色粉末时,产生无刺激性气味的气体,且加入淡黄色粉末时产生白色沉淀的量如图所示:
(12分)有一透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入一种淡黄色粉末状固体时,加热有刺激性气味的混合气体放出,同时生成白色沉淀。当加入0.4 mol淡黄色粉末时,产生气体0.3mol,继续加入淡黄色粉末时,产生无刺激性气味的气体,且加入淡黄色粉末时产生白色沉淀的量如图所示:






 根据题意回答下列问题:
根据题意回答下列问题:
 (1)淡黄色粉末为________________(填名称)。
(1)淡黄色粉末为________________(填名称)。
 (2)溶液中肯定有_____ _______离子,肯定没有_____ _______离子。
(2)溶液中肯定有_____ _______离子,肯定没有_____ _______离子。
 (3)溶液中离子的物质的量之比为______
______
(3)溶液中离子的物质的量之比为______
______
 (4)写出下列方程式:
(4)写出下列方程式:
 ①淡黄色粉末与水反应的化学方程式:______________________
_
①淡黄色粉末与水反应的化学方程式:______________________
_
 ②沉淀部分减少时反应的离子方程式:_______________________ __________
②沉淀部分减少时反应的离子方程式:_______________________ __________





22. (8分)向100mL 3mol/L的NaOH溶液中缓慢通入一定量的CO2 ,充分反应,测得最后溶液的PH>7。
(8分)向100mL 3mol/L的NaOH溶液中缓慢通入一定量的CO2 ,充分反应,测得最后溶液的PH>7。
 (1)此时溶液的溶质若是单一成分,可能是 或
;如果是多种成分,可能是
或
(1)此时溶液的溶质若是单一成分,可能是 或
;如果是多种成分,可能是
或
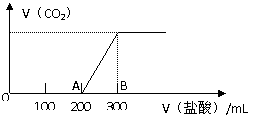
 (2)在上述所得溶液中,逐滴缓慢滴加1mol/L的盐酸,所得气体的体积与所加盐酸的体积(不考虑溶解于水)关系如图所示。
(2)在上述所得溶液中,逐滴缓慢滴加1mol/L的盐酸,所得气体的体积与所加盐酸的体积(不考虑溶解于水)关系如图所示。



①B点时, 产生的CO
产生的CO 在标准状况下的体积为__ ______mL
在标准状况下的体积为__ ______mL
 ②B点时,反应所得溶液中溶质的物质的量浓度是__
__(溶液体积的变化忽略不计)
②B点时,反应所得溶液中溶质的物质的量浓度是__
__(溶液体积的变化忽略不计)
21. (10分)现代循环经济要求综合考虑环境污染和经济效益。请填写下列空白。
(10分)现代循环经济要求综合考虑环境污染和经济效益。请填写下列空白。
(1)实验室里,可用于吸收SO2尾气的一种试剂是 。
(2)高纯氧化铁可作现代电子工业材料。以下是用硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、 FeO、SiO2)为原料制备高纯氧化铁(软磁α- Fe2O3)的生产流程示意图:
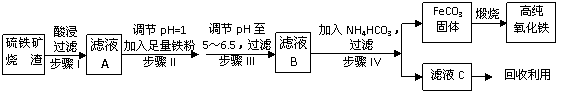
 ①步骤I中过滤所得滤渣的主要成分是
。
①步骤I中过滤所得滤渣的主要成分是
。
②步骤II中加入铁粉的目的是 。
③步骤Ⅲ中可选用 试剂调节溶液的pH(填标号)。
A.稀硝酸 B.双氧水 C.氨水 D.高锰酸钾溶液
④写出在空气中煅烧FeCO3,制备高纯氧化铁的化学方程式
。
⑤从滤液C中回收的主要物质的一种用途是 。
20.
 (8分)X、Y、Z为三种常见的单质,Z为绿色植物光合作用后的产物之一,A、B为常见的化合物。它们在一定条件下可以发生如图所示的转化关系(反应均不是在溶液中进行的)(以下每空中填入一种即可)。
(8分)X、Y、Z为三种常见的单质,Z为绿色植物光合作用后的产物之一,A、B为常见的化合物。它们在一定条件下可以发生如图所示的转化关系(反应均不是在溶液中进行的)(以下每空中填入一种即可)。




 (1)当X、Y均为金属时,Y的化学式为
,B的化学式为
(1)当X、Y均为金属时,Y的化学式为
,B的化学式为
 (2)当X为非金属且为气体,Y为金属且为紫红色时,X的化学式为 ,A的化学式为
(2)当X为非金属且为气体,Y为金属且为紫红色时,X的化学式为 ,A的化学式为
 (3)当X为金属、Y为非金属且为固体时,X与A反应的化学方程式为
(3)当X为金属、Y为非金属且为固体时,X与A反应的化学方程式为
 (4)当X、Y均为非金属固体时,X与A反应的化学方程式为
(4)当X、Y均为非金属固体时,X与A反应的化学方程式为
19.
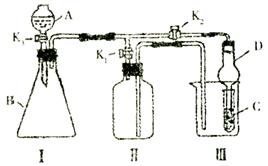
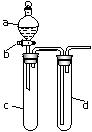 (10分)某兴趣小组同学共同设计了如图所示的实验装置,既可用于制取气体,也可用于验证物质的性质。请回答下列问题:
(10分)某兴趣小组同学共同设计了如图所示的实验装置,既可用于制取气体,也可用于验证物质的性质。请回答下列问题:
(1)利用装置Ⅰ、Ⅱ制取气体(K2关闭,K1打开)。
甲同学认为:利用装置Ⅱ可以收集H2、NH3等气体,但不能收集O2和NO,你认为是否正确 (填“是”“否”),理由是
乙同学认为:利用装置Ⅱ作简易改进(不改变仪器装置),可收集NO2气体,改进的方法是
丙同学认为:利用装置Ⅱ作简易改进(改变仪器装置),可收集NO2气体,改进的方法是
(2)利用装置Ⅰ、Ⅲ验证物质的性质(K2打开,K1关闭)。如设计实验证明氧化性:KMnO4>Cl2>Br2,则在A中加浓盐酸,B中加 ,C 中加 ,观察到C中的现象是 。



18.
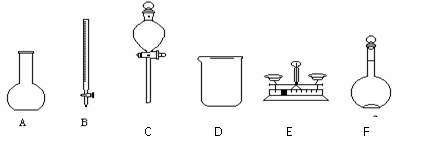
 (6分)用5.0mol﹒L-1的NaOH溶液配制0.1mol﹒L-1的NaOH溶液时,如图所示的仪器中,肯定不需要的是_________(填序号),配制上述溶液还需要的玻璃仪器是___________________(填仪器名称)。
(6分)用5.0mol﹒L-1的NaOH溶液配制0.1mol﹒L-1的NaOH溶液时,如图所示的仪器中,肯定不需要的是_________(填序号),配制上述溶液还需要的玻璃仪器是___________________(填仪器名称)。








 (2)在配制过程中,下列操作将导致实际所配NaOH溶液浓度偏低的是(填编号)____________
(2)在配制过程中,下列操作将导致实际所配NaOH溶液浓度偏低的是(填编号)____________
 ①准确取出的浓NaOH溶液在空气中露置时间过长;
①准确取出的浓NaOH溶液在空气中露置时间过长;
 ②用量器将浓NaOH溶液直接加入容量瓶,缓慢加入蒸馏水至液面最低点恰好和环形刻度线相切;
②用量器将浓NaOH溶液直接加入容量瓶,缓慢加入蒸馏水至液面最低点恰好和环形刻度线相切;
 ③摇匀后,液面低于刻度线,再加蒸馏水至液面最低点恰好和环形刻度线相切;
③摇匀后,液面低于刻度线,再加蒸馏水至液面最低点恰好和环形刻度线相切;
 ④稀释NaOH溶液的仪器未洗涤。
④稀释NaOH溶液的仪器未洗涤。
17.硝酸铜是制备Cu-Zn-Al系催化剂的重要原料,制取硝酸铜现有三种设计方案可供选用:
①Cu与稀硝酸反应制取:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
②Cu与浓硝酸反应制取:Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O
③通氧气于铜屑与稀硝酸的体系中制取:2Cu+4HNO3+O2=2Cu(NO3)2+2H2O
下列说法正确的是
A.制取相同量的硝酸铜需硝酸的量③最多
B.制取相同量的硝酸铜①产生的有毒气体比②多
C.三种方案中硝酸的利用率③>①>②
D.三种方案的反应都可以在铁制容器中进行
高三阶段性教学质量检测
化学试题
 第Ⅱ卷(非选择题 共54分)
第Ⅱ卷(非选择题 共54分)
16. 下列溶液中,各组离子一定能大量共存的是
下列溶液中,各组离子一定能大量共存的是
 A.使酚酞试液变红的溶液: Na+、Cl-、SO42-、Fe3+
A.使酚酞试液变红的溶液: Na+、Cl-、SO42-、Fe3+
 B.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl-
B.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl-
 C.碳酸氢钠溶液:K+、SO42-、Cl-、H+
C.碳酸氢钠溶液:K+、SO42-、Cl-、H+
 D.c(H+)=10-12
mol·L-1的溶液:K+、Ba2+、Cl-、Br-
D.c(H+)=10-12
mol·L-1的溶液:K+、Ba2+、Cl-、Br-
15. 在BaCl2溶液中通入SO2气体,溶液仍澄清。若将BaCl2溶液分盛到两个试管中,其中一支加入硝酸,另一支加入烧碱,然后再通入SO2气体,结果两支试管都要白色沉淀生成。由此得知下列结论合理的是
在BaCl2溶液中通入SO2气体,溶液仍澄清。若将BaCl2溶液分盛到两个试管中,其中一支加入硝酸,另一支加入烧碱,然后再通入SO2气体,结果两支试管都要白色沉淀生成。由此得知下列结论合理的是
 ①BaCl2有两性
②两支试管中生成的白色沉淀均是BaSO3
①BaCl2有两性
②两支试管中生成的白色沉淀均是BaSO3
 ③SO2有还原性其水溶液具有酸性 ④升高PH会使SO2水溶液中的SO32-浓度增大
③SO2有还原性其水溶液具有酸性 ④升高PH会使SO2水溶液中的SO32-浓度增大
 A.①②
B.②③
C.③④
D.①④
A.①②
B.②③
C.③④
D.①④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com