
1、C 2、B 3、D 4、AD 5、C 6、A 7、D 8、D
2.本题可以设取100 ml(cm3)氨水,根据

该题也可以分析理解公式中或题意中的等体积水稀释,由于水的密度大于氨水,则稀释后的质量大于2倍氨水质量,从而不用公式,只须推理就能得到结论。关键在于等体积而不是等质量的水。
新活题网站
1、C 2、C 3、(1)S=ω/(100-ω) × 100 g
(2)c=25m/V mol•L-1 (3)0.25 dω mol•L-1
(4)4c/d %
讲析:1.先计算若3.5 gNaCl能溶于6.5 gH2O,所得溶液质量分数为:
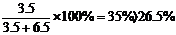
由此可知,加入的NaCl并不能完全溶解,所以溶液仍为饱和溶液。
19.下面是四种盐在不同温度下的溶解度(g/100g水):
|
|
NaNO3 |
KNO3 |
NaCl |
KCl |
|
10℃ |
80.5 |
20.9 |
35.7S |
31.0 |
|
100℃ |
175 |
246 |
39.1 |
56.6 |
(计算时假定:①盐类共存时不影响各自的溶解度;②过滤晶体时,溶剂损耗忽略不计)
(1)取23.4 gNaCl和40.4 gKNO3,加70.0 gH2O),加热溶解。在100℃时蒸发掉50.0gH2O,维持该温度,过滤出晶体,计算所得晶体的质量(m高温)。将滤液冷却至10℃,待充分结晶后,过滤。计算所得晶体的质量(m低温)。
(2)另取34.0 gNaNO3和29.8 gKCl,同样进行如上实验。10℃时析出的晶体是 (写化学式)。100℃和10℃得到的晶体质量m’高温和m’低温分别是多少?
第7课时 (A卷)答案与讲析:
典型题点击
18.今有36.5g10%的盐酸与40g一定溶质质量分数的氢氧化钠溶液恰好完全反应,把反应后的溶液蒸发掉54.4g水后,再冷却至20℃,溶液刚好达到饱和,求20℃时此反应生成物的溶解度。
17.(2000全国)将某温度下的KNO3溶液200g蒸发掉10g水,恢复到原温度,或向其中加入10gKNO3固体,均可使溶液达到饱和。试计算:(1)该温度下KNO3的溶解度。(2)原未饱和溶液中溶质的质量分数。
16.著名的“侯氏制碱法”第一步反应是向饱和氨化盐水中通入二氧化碳,该反应可表示为:
NaCl + NH3 + CO2 + H2O = NaHCO3 + NH4Cl
有关物质的溶解度数据如下(g/100g水):
NaCl NaHCO3 NH4Cl
10℃ 35.8 8.15 33.0
45℃ 37.0 14.0 50.0
现有45℃时,向434 g 饱和食盐水中通入适量氨气,再向其中通入过量二氧化碳后,按上述反应进行完全。试计算并回答下列问题。
(1)反应完全后45℃时析出晶体的化学式是 ,
析出的晶体的质量是 ;
(2)过滤除去晶体后再降温至10℃,此时析出的晶体是(填化学式) ,所析出晶体的质量是 。
15.某工厂采用硫酸和氢氟酸的溶液作为矿物中稀有元素的萃取液,生产要求该萃取液中硫酸的浓度为3mol/L,氢氟酸的浓度为8mol/L。现有一批回收酸液共400mL,经测定其中氢氟酸浓度为12 mol/L,硫酸浓度为1 mol/L。现要用此回收酸液配制上述萃取液,400L回收酸液经稀释可以得到 L8mol/L的氢氟酸,在400L回收酸液中加入 L密度为1.84g/mL、浓度为98%的浓硫酸,然后 ,即可得到符合要求的萃取液。
14.把一小块缺角的硫酸铜晶体悬挂在饱和的硫酸铜溶液中,过几天发现这块晶体完整无缺(在恒温、密闭条件下),这个过程的热效应 ,这时硫酸铜溶液的质量 ,硫酸铜溶液是 。(填代号)
A.变大 B.变小 C.基本不变 D.放热
E.吸热 F.不饱和溶液 G.饱和溶液
13.取20g混有二氧化锰的氯酸钾,加热至恒重。在一定温度下,将残留的固体加入10g水中,有7.9g固体未溶解,再加入5g水仍有5.3g固体未溶。则原混合物中可能含有的KClO3 质量为( )
A.14.7g B.6.9g C.12.1g D.17.6g
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com