
22.实验室使用的浓盐酸的质量分数一般为36.5%,密度为1.19g·cm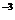 。试问:
。试问:
(1)要配制此浓度的盐酸1.00L,则需要标准状况下的HCl气体多少升?
(2)该浓盐酸对应的物质的量浓度为多大?
(3)在加热的条件下,用MnO2与此浓盐酸反应,制得标准状况下Cl2 0.56L,被氧化的HCl的物质的量是多少?
宁乡县2008年下学期末调研考试高中一年级
20.(6分)某溶液中含有SO42-、CO32-、OH-三种阴离子,如果只取一次该溶液,分别将三种离子检验出来(此处不考虑CO32-产生影响),那么
(1)最先检验出的离子所加入的试剂是; ;
(2)第二步检验出的离子是: (写名称)。
(3)写出最后检验离子的离子方程式: 。
21.(12分)用18.4mol/L的浓硫酸配制100mL浓度为1mol/L的稀硫酸,其操作可分为以下各步(请将步骤中空白处填写完整):
A.用量筒量取 mL浓硫酸,缓缓注入装有约50mL蒸馏水的烧杯里,并用玻璃棒搅拌
B.用约30mL蒸馏水分三次洗涤烧杯和玻璃棒,将每次的洗液都倒入容量瓶里
C.将稀释后的硫酸小心倒入容量瓶里
D.检查100mL容量瓶,是否漏水
E.用玻璃棒引流将蒸馏水加入容量瓶,至液面接近刻线 处
F.盖紧瓶塞,反复颠倒振荡,摇匀溶液
G.用胶头滴管向容量瓶里逐滴加入蒸馏水,到液面最低点恰好与刻线相切
请据此填写:
(1)正确的操作顺序是(用字母填写): 。
(2)进行A步操作后,必须 后才能进行C操作。
(3)此实验配制稀硫酸,除玻璃棒.胶头滴管.试剂瓶外,还需的主要仪器有.
。
(4)下列操作会使所配溶液浓度偏低的是 (填选项代号)
A.转移溶液后没有洗涤烧杯内壁
B.配制前容量瓶内有少量水
C.定容时仰视
D.硫酸溶液未经冷却就转移到容量瓶中去
19.(4分)有X、Y、Z三种元素:
(1)X、Y、Z的单质在常温下均为气体;
(2)X单质可以在Z的单质中燃烧,生成物为XZ,火焰呈苍白色;
(3)XZ极易溶于水,在水溶液中电离出X+和Z-,其水溶液能使蓝色石蕊试纸变红;
(4)每2个X2分子能与1个Y2分子化合成2个X2Y分子,X2Y常温下为液体;
(5)Z单质溶于X2Y中,所得溶液具有漂白性。
请根据以上信息写出所给化合物的分子式: XZ__ ____,X2Y_________。
18.(8分)铜器久置于空气中会和空气中的水蒸气、CO2、O2作用产生“绿锈”,该“绿锈”俗称“铜绿”又称“孔雀石”,化学式为Cu2(OH)2CO3,铜绿能跟酸反应生成铜盐及CO2、H2O。某同学利用下述系列反应实现了“铜→铜绿→……→铜”的转化。
铜 →① 铜绿 →② A → ③Cu(OH)2 → ④B → ⑤Cu
(1)上述反应中,属于复分解反应的是 (填序号);属于氧化还原反应的是
(填序号)。
(2)写出反应①和⑤的化学方程式:
① ⑤ 。
17.(8分)“比较”是化学研究物质性质的基本方法之一,请运用比较法解答下列问题:已知在一定条件下,过氧化钠几乎可与所有的常见气态非金属氧化物反应。如:
2Na2O2+2CO2=2Na2CO3+O2,Na2O2+CO=Na2CO3。
(1)试分别写出Na2O2与SO2、SO3反应的化学方程式。
(2)当1molSO3参加反应时,转移电子的物质的量为 mol。
(3)通过比较可知:在氧化物中,当非金属元素处于 价时,其氧化物与过氧化钠反应就有O2 生成。
16.(8分)某校高一研究性学习小组为了研究造成当地空气污染的主要原因,首先他们对其原因假设为以下四种:
A.燃烧农作物秸秆 B.燃烧含硫煤
C.粉尘污染 D.机动车尾气污染
为此他们运用了走访调查的方法,对当地100位居民和100位环保部门人士进行调查研究,调查结果如下图所示:
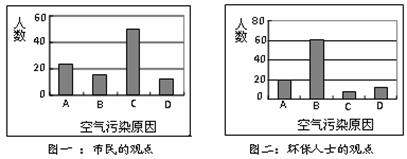
请你根据以上信息回答下列问题:
⑴当地居民认为造成我市空气污染的最主要的原因是 (请填对应的序号,下同),环保人士认为造成本地空气污染的最主要的原因是 。
⑵上述调查结果说明当地居民对造成空气污染的原因认识不足。而环保人士所得结论,其分析造成大气污染的主要有害成分是 ,它在空气中受氧气和水等物质的共同作用,会形成酸雾,其变化的反应方程式可表示为 。
15.在标准状况下有①6.72L
CH4,②3.01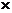 1023个HCl分子,③13.6gH2S,④0.2mol氨气。下列对这四种气体的关系从大到小描述不正确的是
1023个HCl分子,③13.6gH2S,④0.2mol氨气。下列对这四种气体的关系从大到小描述不正确的是
A.体积:②>③>①>④ B.密度:②>③>④>①
C.质量:②>③>①>④ D.氢原子数:①>④>③>②
14.要用萃取法从碘水中分离出碘,下列能用作萃取剂的一组物质是:
①四氯化碳 ②甲苯 ③酒精 ④汽油 ⑤醋酸
A.①②③ B.②④⑤
C. ①②④ D.全部
13.过量的NaHCO3和Na2O2混合,在密闭容器中充分混合加热后,最后排出气体,残留的固体是
A.Na2O B.Na2CO3
C.Na2O2和Na2CO3 D.Na2O和Na2O2
12.下列离子方程式正确的是
A.Cl2与NaOH溶液反应:Cl2+OH―==Cl―+ClO―+H2O
B.氢氧化镁与硫酸溶液反应 OH-+H+= H2O
C.碳酸钙与醋酸溶液反应: CaCO3+2H+ = Ca2++H2O+CO2↑
D.澄清石灰水中加入碳酸钠溶液:Ca2++CO32- == CaCO3↓
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com