
2. 下列各组物质中,晶体类型相同且熔点高低比较正确的是( )
A. 硅、铝合金>铝 B.  C.
C.
 D.
D.
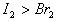
1. 石墨炸弹爆炸时能在方圆几百米范围内撒下大量石墨纤维,造成输电线、电厂设备损坏,这是由于石墨( )
A. 有放射性 B. 易燃易爆 C. 能导电 D. 有剧毒
6. 酸式盐和碱反应的方程式书写:
分析与书写酸式盐与碱反应的过程首先要从实质入手。酸式盐(大多数可溶)与碱反应的一个重要本质是中和--在碱溶液存在的条件下,酸式盐中可以电离出H+,不得不全部(或部分)电离出来与OH-结合成水,于是酸式酸根离子就转化为酸根离子,溶液中的酸根离子将首先将能产生难溶物的阳离子沉淀析出,整个反应过程既遵守质量守恒又遵守电荷守恒,产物的确定就要根据酸式酸根中的H+与碱提供的OH-的相对量决定:如
(1)NaHCO3溶液与少量Ca(OH)2混合:
析: 少量,
少量, 可提供足量,H+可将全部OH-中和:
可提供足量,H+可将全部OH-中和:
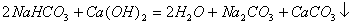
(2) 溶液与过量
溶液与过量 混合
混合
析: 过量,则
过量,则 不足,H+只能中和部分OH-:
不足,H+只能中和部分OH-:

请试写下列反应:
(3) 少量
少量
(4) 过量
过量
(5)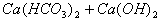 少量
少量
(6) 过量
过量
答案如下:
(3)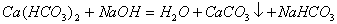
(4)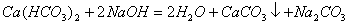
(5)
(6)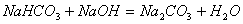
注:(5)(6)反应中为同种阳离子,因此提供的 与
与 是一样多的,因此“少量”、“过量”已不影响反应结果。
是一样多的,因此“少量”、“过量”已不影响反应结果。
[典型例题]
[例1] 最近,科学家研制得一种新的分子,它具有空心的类似足球状结构,分子式为C60,下列说法正确的是( )
A. C60是一种新型的化合物
B. C60和石墨都是碳的同素异形体
C. C60中含离子键
D. C60的式量是720
解析:这是一道信息题,但考查了最基本的概念:单质和化合物,同素异形体,离子键和共价键等。请同学们注意题中“分子”“分子式”等关键词,再加入以上基本概念的准确掌握,即可顺利得出答案。
答案:BD
评注:本章是非金属部分不算重要的章节,但就高考题而言,在某些年份占有较大比重,尤其是多以C60、CO2与温室效应,新型无机材料为载体考查了化学基本理论、基本概念,甚至“3+X”学科间的综合(见例4)
[例2] 锗酸铋简称BGO,是我国新研制成功的一种性能优良的闪烁晶体材料,其中Ge处于最高价,Bi的价态与它跟氯形成的某种共价氯化物中的价态相同,而且在此氯化物中,铋具有8电子稳定结构,则BGO的化学式为( )
A. 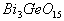 B.
B.
 C.
C.
 D.
D.
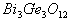
解析:锗处于IVA,最高正价为 ;铋的氯化物中能使Bi满足8电子稳定结构,由于Bi是VA元素,所以,是
;铋的氯化物中能使Bi满足8电子稳定结构,由于Bi是VA元素,所以,是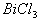 ,
, 为
为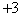 价。再运用化合物的化合价代数和为0的原则,确定B选项。
价。再运用化合物的化合价代数和为0的原则,确定B选项。
答案:B
[例3] 120℃、101.3 kPa条件下,有2L 、2L
、2L 、1L
、1L 、0.5L
、0.5L 和1L
和1L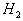 组成的混合气体。将混合气体通过分别放足量Cu粉、C粉和CuO粉的三个灼热的反应管。假设气体通过每个反应管都能充分反应,且不记三个反应管以何种顺序排列,问:
组成的混合气体。将混合气体通过分别放足量Cu粉、C粉和CuO粉的三个灼热的反应管。假设气体通过每个反应管都能充分反应,且不记三个反应管以何种顺序排列,问:
(1)尾气是否有可能是单一气体?__________(填“可能”或“不可能”)。若可能,该气体是__________。
(2)原气体中是否有几种(或一种)不可能再存在于尾气之中?__________(填“有”或“没有”)。若有,它们(或它)是__________。
(3)原气体中是否有几种(或一种)一定存在于尾气中?__________(填“有”或“没有”)。若有,它们(或它)是__________。
解析:解题思路有2条:第一条是按部就班,非常烦琐;第二条是抓住关键,删繁就简。请同学认真体会:
方法一:因为Cu、C、CuO三种物质排列有6种顺序,列出混合气体6种串连方式的结果如下:
① 混合气体
② 混合气体
③ 混合气体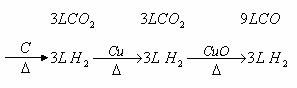
④ 混合气体
⑤ 混合气体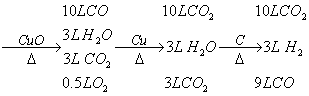
⑥ 混合气体
从而得出结论。
(1)尾气不可能是单一气体,它只可能是H2和CO,或H2O和CO2两种情况。
(2)原气体中O2,无论是遇到Cu或C(还原剂),即被耗去,不再出现于尾气中
(3)最后得到的尾气只有两种可能组合,还原性的CO和H2,或氧化性的CO2和H2O。所以不能说尾气中肯定有哪一种(或哪些种)气体。
方法二:仔细分析Cu的作用只有一个,那就是吸收O2,且吸收完全,而其它过程又不产生O2,O2与CuO不作用。O2与足量C作用产生CO,若先产生,则混合物原来就有,若后产生,试想CO2与C最后亦能产生CO,故对尾气无影响。故可将O2、Cu从题中抹去,这样问题变得简单起来,只有2种顺序:
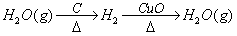
CO、CO2 CO CO2

CO、CO2 CO2 CO
由于该问与体积无关,所以可以不考虑各气体的体积。
答案:(1)不可能;(2)有;O2;(3)没有
评注:不忙于作罗列式的6种可能情况,而是仔细的分析混合气体中各组份跟3种试剂的反应实质,敏感地看出8个反应都是氧化还原反应,试剂中一个是氧化剂,两个是还原剂。然后推理,可以大大缩短时间。在兼有难度和速度的高考中,时间也是不可忽视的因素。
[例4] 1996年诺贝尔化学奖授予对发现C60有重大贡献的三位科学家。C60分子是形如足球状的多面体,如图所示:

该结构建立基于以下考虑:
(1)C60分子中每个碳原子只能跟相邻的3个碳原子形成共价键;
(2)C60分子中只含有五边形和六边形;
(3)多面体的顶点数,面数和棱边数的关系遵循欧拉定理:
顶点数+面数-棱边数=2
据上述可推知,C60中有12个五边形和20个六边形,C60分子中所含双键数为30。
回答下列问题:
(1)与金刚石相比,熔点较高是_____________(填“金刚石”或“C60”),理由是__________________________。
(2)试估计C60与F2在一定条件下,能否生成C60F60_____________(填“能”或“不可能”),并简述理由__________________________。
(3)通过计算确定C60分子中所含单键数为_____________。
(4)C70分子空间结构与C60相似,通过计算确定C70分子中的五边形和六边形的数目。
解析:
(1)金刚石为原子晶体,而C60为分子晶体,所以肯定是金刚石熔点高。
(2)可能,只要是F2与C60在一定条件下完全加成即可,因为已经告诉了C60中有30个双键,由烯烃加成原理可推知这是可能的。
(3)有2种方法:
一:共有60个C原子,每个C原子形成3个共价键,而每个共价键又是两个C原子共同参予构成,所以在C60中共有共价键数: 。由其结构知共价键数即棱边数。共有90个共价键。其中有30个双键,所以单键为60。
。由其结构知共价键数即棱边数。共有90个共价键。其中有30个双键,所以单键为60。
二:利用欧拉定理: 棱边数
棱边数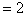 ,求得棱边数为90,即单双键共为90,所以单键为60。
,求得棱边数为90,即单双键共为90,所以单键为60。
(4)设共有五边形 个,六边形
个,六边形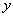 个。
个。

解得 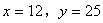
答案:(1)金刚石;略 (2)可能;略 (3)60
(4)五边形12个,六边形25个。
[模拟试题]
5. 常见硅酸盐产品比较

4. 硅及其化合物“反常”性质:
(1)硅的还原性比碳弱,但碳在高温下却能从SiO2中还原出硅:

这是由于生成物CO气体逸出原因。
(2)非金属单质与强碱反应一般不生成氢气(请回忆Cl2)而硅却能:

(3)虽然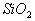 是硅酸的酸酐,但却不能用
是硅酸的酸酐,但却不能用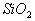 与水反应生成硅酸,而只能用硅酸盐跟较强酸(HCl、H2CO3)制得。
与水反应生成硅酸,而只能用硅酸盐跟较强酸(HCl、H2CO3)制得。
(4)酸性氧化物一般不与酸反应(除氧化还原反应外),而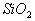 却能与氢氟酸反应,但与其它常见酸不反应。(H2SO4、HNO3、HCl等)
却能与氢氟酸反应,但与其它常见酸不反应。(H2SO4、HNO3、HCl等)
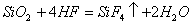 (氢氟酸可腐蚀玻璃)
(氢氟酸可腐蚀玻璃)
(5)非金属氧化物一般是分子晶体(如CO2、NO2、SO2等),而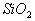 却是原子晶体。
却是原子晶体。
(6)无机酸一般易溶于水,而硅酸和原硅酸(H4SiO4)却难溶于水。
(7)较强酸能把较弱酸从其盐溶液中制取出来,这是复分解反应的一般规律,因此H2CO3可制H2SiO3: ,但在高温下
,但在高温下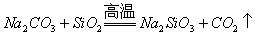 却能由较弱酸性氧化物制得较强酸性氧化物,其原因是,生成的CO2是气体,离开反应体系而使反应进行到底。
却能由较弱酸性氧化物制得较强酸性氧化物,其原因是,生成的CO2是气体,离开反应体系而使反应进行到底。
(8)硅酸钠的水溶液俗称水玻璃,但它和玻璃的成分不完全相同,硅酸钠也俗称泡花碱,但它是盐不是碱。
(9)钢化玻璃与普通玻璃成份相同,石英玻璃与普通玻璃成份却不同。
3. CO的有关知识:
(1)物理性质:
无色无味气体,密度接近空气,难溶于水,有剧毒。
(2)化学性质:
CO的化学性质主要是还原性,如:
 (可燃性)
(可燃性)
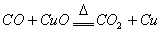 (冶炼金属)
(冶炼金属)
2. CO2与SiO2
|
|
CO2 |
SiO2 |
|
电子式 |
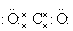 |
/ |
|
晶体类型 |
分子晶体 |
原子晶体 |
|
俗称 |
干冰(固态时) |
硅石、石英、水晶 |
|
化学性质 |
1. 酸性氧化物  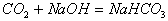  2. 弱氧化性: 2. 弱氧化性:  |
酸性氧化物 SiO2不能与水反应生成H2SiO3   |
1. 碳(金刚石为例)、硅单质的比较
列表如下:
|
|
碳 |
硅 |
|
原子结构示意图 |
 |
 |
|
原子半径 |
相对较小 |
相对较大 |
|
单质晶体类型 |
原子晶体(金刚石) |
原子晶体 |
|
单质熔点 |
熔点很高 |
比金刚石稍低 |
|
化学性质 |
1. 还原性: (可燃性) (可燃性)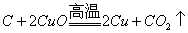 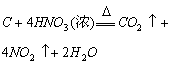  (制粗硅) (制粗硅) (制水煤气) (制水煤气)2. 氧化性  |
还原性: 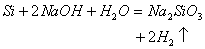 |
2. 硅单质、SiO2的重要性质
1. 碳单质、CO、CO2、碳酸盐的重要性质
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com