
19.某种含有少量氧化钠的过氧化钠试样(已知试样质量为1.560g、锥
形瓶和水的质量为190.720g),利用左图装置测定混合物中Na2O2的质量分数,每隔相同
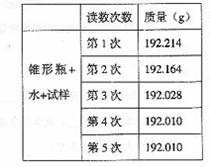 时间读得电子天平的数据如表:
时间读得电子天平的数据如表:
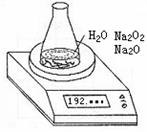
(1)写出Na2O2和H2O反应的化学方程式
(2)计算过氧化钠质量分数时,必需的数据是
不必作第6次读数的原因是
(3)测定上述样品(1.560g)中Na2O2质量分数的另一种方案,其操作流程如下:
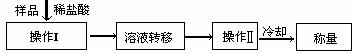
①操作Ⅱ的名称是
②需直接测定的物理量是
③测定过程中需要的仪器有电子天平、蒸发皿、酒精灯,还需要 、 (固定、夹持仪器除外)
④在转移溶液时,如溶液转移不完全,则Na2O2质量分数的测定结果 (填偏大、偏小或不变)。
18.(1)请将5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
_________+__________→__________+__________+__ ________+H2O
________+H2O
(2)反应物中发生氧化反应的物质__________,被还原的元素是_________。
(3)反应中1 mol氧化剂_______(填“得到”或“失去”)___________ mol电子。
(4)请将反应物的化学式及配平后的系数填入下列相应的位置中:
__________+ __________→
17.氧化铜有多种用途,如用作玻璃着色剂、油类脱硫剂等。为获得纯净的氧化铜以探究其性质,某同学用工业硫酸铜(含硫酸亚铁等杂质)进行如下实验:
|


|

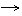
|
①步骤I的目的是除不溶性杂质。操作是 。
②步骤Ⅱ的目的是除铁。操作是:滴加H2O2溶液,稍加热;当Fe2+转化完全后,慢慢加入Cu2(OH)2CO3粉末,搅拌,以控制溶液pH=3.5;加热煮沸一段时间,过滤,用稀硫酸酸化滤液至pH=1。控制溶液pH=3.5的原因是 。
③步骤Ⅲ的目的是得到CuSO4·5H2O晶体。操作是 ,过滤,水浴加热烘干。水浴加热的特点是 。
⑵探究氧化铜的性质
①取A、B两支试管,往A中先加入适量CuO粉末,再分别向A 和B中加入等体积的3%H2O2溶液,只观察到A中有大量气泡。结论是 。
②为探究试管A中反应的速率,收集气体并测定其体积必需的实验仪器有:
。
16.将几滴KSCN溶液(SCN-是“类卤离子”)加入酸性Fe3+溶液中,溶液立即变成红色①,将此红色溶液分为两份,一份中加入KMnO4溶液,红色褪去②;向另一份红色溶液中通入SO2时红色也消失③,再滴加KMnO4溶液,其紫色也褪去④,试解释以上画线四部分颜色变化的原因,并写出有关反应的离子方程式:
①
②
③
④
15.已知某溶液中存在较多的H+、SO42-、NO3-,则溶液中还可能大量存在的离子组是
A.A13+、CH3COO-、C1- B.Na+、NH4+、C1-
C.Mg2+、C1-、Fe2+ D. Mg2+、Ba2+、Br-
14.将相同质量的铜分别和过量浓硝酸、稀硝酸反应,下列叙述正确的是
A.反应速率:两者相同 B.消耗硝酸的物质的量:前者多,后者少
C.反应生成气体的颜色:前者浅,后者深 D.反应中转移的电子总数:前者多,后者少
13.下列反应中,氧化剂与还原剂物质的量的关系为1∶2的是
A.O3+2KI+H2O==2KOH+I2+O2
B.2CH3COOH+Ca(ClO)2==2HClO+Ca(CH3COO)2
C.I2+2NaClO3==2NaIO3+Cl2
D.4HCl+MnO2==MnCl2+Cl2↑+2H2O
12.下列离子方程式正确的是
A.Cl2与NaOH溶液反应:Cl2+2OH-==Cl-+ClO-+H2O
B.F2与NaOH溶液反应:F2+4OH-==2F-+O2+2H2O
C.AgNO3溶液中加入过量氨水:Ag++2NH3·H2O==Ag(NH3)2++2H2O
D.Fe3O4与稀HNO3反应:Fe3O4+8H+==Fe2++2Fe3++4H2O
11.将一定量的Fe和Fe2O3的混合物投入250mL、1.8mol/L的HNO3溶液中,当固体混合物完全溶解后,在标准状况下生成1.12LNO(HNO3的还原产物仅此一种),再向反应后的溶液中加入1.0mol/LNaOH溶液,若要使铁元素完全沉淀下来,所加入的NaOH溶液体积最少应为
A.300mL B.400mL C.450mL D.500mL
10.在一定条件下,RO3n-与氟气可发生如下反应:
RO3n- + F2 + 2OH- = RO4- + 2F- + H2O
从而可知在RO3n-中,元素R的化合价是
A、+4 B、+5 C、+6 D、+7
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com