
(2) KOCN+ KOH+ Cl2 → CO2 + N2 + KCl + H2O
(配平得2分,电子转移得2分)(3) (2分)
22、(6分)有一混合溶液,其中只含有Fe2+、Cl-、Br-、I- (忽略水的电离),其中Cl-、Br-、I-的个数比为2∶3∶4,向该溶液中通入氯气,使溶液中Cl-和Br-的个数比为3∶1,求通入氯气的物质的量与溶液中剩余的Fe2+的物质的量之比。(已知:还原性I->Fe2+>Br->Cl-)
(忽略水的电离),其中Cl-、Br-、I-的个数比为2∶3∶4,向该溶液中通入氯气,使溶液中Cl-和Br-的个数比为3∶1,求通入氯气的物质的量与溶液中剩余的Fe2+的物质的量之比。(已知:还原性I->Fe2+>Br->Cl-)

 平定一中高三第一学期9月份月考化学试题答题纸
平定一中高三第一学期9月份月考化学试题答题纸
(满分:100分 考试时间:90分钟)
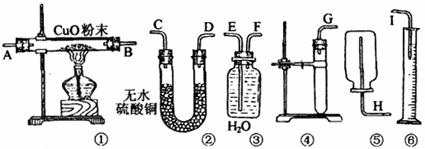
(1)应选用的装置是(只要求写出图中装置的标号) 。
(2)所用装置的连接顺序是(填各接口的字母,胶管省略) 。
(3)为了保证不漏出氢气,操作中加放试剂的方法是 。
(4)用实验所测得的数据,写出计算锌的相对原子质量的数学式:Mr(Zn)= 。
21.(12分)某研究性学习小组在探究铝表面氧化膜对铝的保护时,设计了如下实验:
⑴取一小块铝片和一块锌片放入稀H2SO4中,看到锌片与酸反应产生H2速率很快,而铝片刚开始时,几乎看不到有气体,一段时间后,才看到有气体放出,随后产生气体速度逐渐加快,试解释其原因_________________________________________
______________________________________________________________________。
⑵将铝片放入NaOH溶液,待看到有气体产生,取出铝片,用水洗涤,其作用是________________,该反应的化学方程式是________________________________。
⑶洗涤后的铝片放入Hg(NO3)2溶液,反应片刻。反应的化学方程式是___________
__________________________。
⑷取出铝片用滤纸吸干后,在空气中很快就看到铝片上慢慢生成白色毛状物质,经分析该物质为氧化铝。写出反应的化学方程式____________________________,解释生成白色毛状物质的原因__________________________________________。
温室气体。其转化关系如图所示(反应条件和部分产物略去)。试回答:
 (1)F的电子式为
;
(1)F的电子式为
;
(2)少量的金属单质铝与D和F混合,写
出反应的离子方程式
。
(3)D2mol、E 2mol与3molF在密闭容器
中充分反应,所得固体成分为
;其相应的物质的量为
。
19、(8分)已知有以下物质相互转化

试回答:(1)写出B的化学式 ,D的化学式 。
(2)写出由E转变成F的化学方程式 。
(3)写出鉴别G溶液中阳离子的实验方法 _________________;
向G溶液加入A的有关离子反应方程式 。
(1)某厂废水中含KCN,其浓度为650mg / L。现用氯氧化法处理,发生如下反应(其中N均为
-3价):
KCN+2KOH+Cl2 → KOCN+2KCl+H2O被氧化的元素是 __________ 。
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气。请配平下列化学方程式,并标出电子转移方
向和数目:
KOCN+ KOH+ Cl2 → CO2 + N2 + KCl + H2O
(3)若处理上述废水20L,使KCN完全转化为无毒物质,至少需液氯 g。
16、
 下列关于金属钠及其化合物的叙述:①苛性钠又称纯碱 ②钠原子最外层电子只有1个电子,所以在化合物中钠只显+1价 ③过氧化钠中氧元素化合价为-1价 ④钠离子具有还原性,可以从水中还原出氢气 ⑤金属钠只有还原性,没有氧化性。上述叙述中正确的是( )(A)①②③ (B)③④⑤ (C)②③⑤
(D)①②⑤
下列关于金属钠及其化合物的叙述:①苛性钠又称纯碱 ②钠原子最外层电子只有1个电子,所以在化合物中钠只显+1价 ③过氧化钠中氧元素化合价为-1价 ④钠离子具有还原性,可以从水中还原出氢气 ⑤金属钠只有还原性,没有氧化性。上述叙述中正确的是( )(A)①②③ (B)③④⑤ (C)②③⑤
(D)①②⑤
第Ⅱ卷(非选择题 共52分)
15、下列反应的离子方程式正确的是( )
A.向沸水中滴加饱和FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O==Fe(OH)3+3H+
B.向NaHCO3溶液加入少量Ca(OH)2溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O
C.硫酸铝溶液与碳酸氢钠溶液混合:Al3++3HCO3-=Al(OH)3↓+3CO2↑
D.向盐酸中滴加氨水:H++OH-=H2O
14、关于合金性质的说法中,错误的是 ( )
A.多数合金的硬度一般比其各成分金属的硬度高
B.多数合金的熔点一般比其各成分金属的熔点低
C.合金的物理性质一般与其各成分金属的物理性质不同
D.合金的化学性质一般与其各成分金属的化学性质不同
13、实验室有甲乙两瓶无色溶液,其中一瓶为稀盐酸,另一瓶为碳酸钠溶液,现进行以下实验:
①量取25.00mL甲溶液,向其中缓缓滴入乙溶液15.00mL,共收集到224mL(标况下)气体。
②量取乙溶液15.00mL,向其中缓缓滴入甲溶液25.00mL,共收集到112mL(标况下)气体。
下列说法正确的是( )
A.甲是盐酸,乙是碳酸钠 B.甲是碳酸钠,乙是盐酸
C.②中的反应离子方程式:CO32-+2H+=CO2↑+H2O D.无法判断
12、等物质的量的N2、O2、CO2的混合气体,通过Na2O2后,相同条件下测得混合气体的体积是原来的
8/9,则此时混合气体中的三者物质的量之比是( )
A.1:1:0 B.3:4:0.5 C.1.5:2:0.5 D.3:3:2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com