
例1. (2005年烟台市检测题)如图1所示,将一根不可伸长、柔软的轻绳左、右两端分别系于A、B两点上,一物体用动滑轮悬挂在轻绳上,达到平衡时,两段绳子间的夹角为 ,绳子张力为
,绳子张力为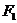 ;将绳子右端移到C点,待系统达到平衡时,两段绳子间的夹角为
;将绳子右端移到C点,待系统达到平衡时,两段绳子间的夹角为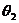 ,绳子张力为
,绳子张力为 ;将绳子右端再由C点移到D点,待系统达到平衡时,两段绳子间的夹角为
;将绳子右端再由C点移到D点,待系统达到平衡时,两段绳子间的夹角为 ,绳子张力为
,绳子张力为 ,不计摩擦,并且BC为竖直线,则( )
,不计摩擦,并且BC为竖直线,则( )
A. 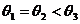 B.
B.
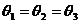
C. 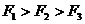 D.
D.
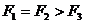

图1
解析:由于跨过滑轮上绳上各点的张力相同,而它们的合力与重力为一对平衡力,所以从B点移到C点的过程中,通过滑轮的移动,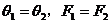 ,再从C点移到D点,
,再从C点移到D点, 肯定大于
肯定大于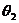 ,由于竖直方向上必须有
,由于竖直方向上必须有 ,所以
,所以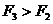 。故只有A选项正确。
。故只有A选项正确。
(五)物质的量(n)、气体的体积(V)和气体摩尔体积(Vm)在一定状况下三者关系式:n=V/Vm。
[思考感悟]
1、描述气体体积时,为什么要限定条件?
气体体积除与气体分子数的多少有关外,还与外界温度、压强有关,只有在限定条件下,才能对其体积和物质的量进行计算。
2、1mol气体只有在标准状况时才是22.4L吗?
不一定。因为气体体积受温度和压强的影响。在标准状况时,1mol任何气体的体积都约为22.4L,在升高温度,增大压强或减小压强,降低温度时,1mol气体的体积也可能是22.4L。
[基础训练]
1、下列说法正确的是( D )
①标准状况下,22.4L己烯含有的分子数约为6.02×1023;
②标准状况下,a L的氧气和氮气的混合物含有的分子数约为a×6.02×1023/22.4;
③7.1g氯气与足量的氢氧化钠溶液反应转移的电子数约为0.2×6.02×1023;
④10g重水中含有的中子数约为4×6.02×1023;
⑤1mol乙醇中含有的共价键数约为7×6.02×1023;
⑥500mL1mol·L-1的硫酸铝溶液中含有的硫酸根离子数约为1.5×6.02×1023。
A、①④ B、②⑤ C、③⑤ D、②⑥
2、在25℃、100kPa条件下,将15LO2通入10LCO和H2的混合气体中,使其完全燃烧,干燥后,恢复至原来的温度和压强。
(1)若剩余气体的体积是15L,则原CO和H2的混合气体中:V(CO)=5L,V(H2)=5L。
(2)若剩余气体的体积为a L,则原CO和H2的混合气体中V(CO)︰V(H2)=(a-10)/(20-a),a的取值范围是10<a<20。
(2H2+O2=2H2O(l),2CO+O2=2CO2(g)。10L混合气体完全燃烧只需要5LO2,故15LO2过量。反应后O2剩余10L。(1)若剩余气体15L,其中有10LO2和5LCO2,故V(CO)=5L,V(H2)=(10-5)L=5L;(2)若剩余气体为aL,其中有10LO2和(a-10)LCO2,则V(CO)=(a-10)L,V(H2)=10L-(a-10)L=(20-a)L,V(CO)/V(H2)=(a-10)/(20-a)。a的取值范围可采用极限假设法求得:若10L气体全部为H2,则反应后剩余10LO2;若10L气体全部为CO,则反应后得到10LCO2和剩余的10LO2。因此a的取值范围为10<a<20)
3、a g铜与一定量的浓HNO3完全反应,生成标准状况下NO2、NO共11.2L,则:
(1)反应中消耗的硝酸为a/32+0.5mol(用a的代数式表示,下同)。
(2)若在11.2LNO2、NO混合气中,至少通入标准状况0.175a LO2使氮的氧化物完全溶解于水。
(本题主要考查原子、电子守恒的计算。(1)依据N原子守恒,则被还原的HNO3的物质的量为11.2L/22.4L·mol-1=0.5mol,酸性作用的硝酸的物质的量为2ag/64g·mol-1=a/32mol,则n(HNO3)消耗=(a/32+0.5)mol。(2)由铜与浓HNO3反应,生成的NO2、NO又与O2反应完全溶于水,转化为硝酸,此过程可看作铜失去的电子全部转给O2,即由电子得失守恒得:2Cu-O2,则标准状况下,V(O2)=ag/64g·mol-1×1/2×22.4L·mol-1=0.175aL。)
[高考模拟]
4、(2008海南化学3)在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是( B )
A、甲的分子数比乙的分子数多 B、甲的物质的量比乙的物质的量少
C、甲的摩尔体积比乙的摩尔体积小 D、甲的相对分子质量比乙的相对分子质量小
(同温、同压下,同质量的甲比乙的密度大,说明甲的体积小于乙的体积,也就说明了甲的物质的量小于乙的物质的量,这是根据阿伏加德罗定律可得出)
5、(2008海南化学4)锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水。当生成1mol硫酸锌时,被还原的硝酸的物质的量为( D )
A、2mol B、1mol C、0.5mol D、0.25mol
(根据电子守恒进行计算)
[作业]
(四)适用范围:只适用于气体,不适用于固体和液体。
(三)数值:在标准状况下(指温度为0℃(273K),压强为1.01×105Pa)约等于22.4L。
(二)单位:L·mol-1或mL·mol-1。
(一)定义:一定温度和压强下,单位物质的量的气体所占的体积。
(三)聚集状态体现物质的物理性质的不同。
(二)同一物质在不同的温度和压强下,聚集状态可能不同,不同的物质在同一温度及压强下,聚集状态也可能不同。
(一)物质以其微粒的直径大小、微粒之间的距离不同而分为固态、液态、气态。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com