
11、(2006全国Ⅰ卷文)已知函数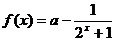 ,若
,若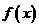 为奇函数,则
为奇函数,则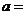 ________。
________。
10.(2008北京理)若实数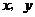 满足
满足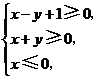 则
则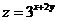 的最小值是( )
的最小值是( )
A.0 B.1 C. D.9
D.9
9.(2008天津文) 已知函数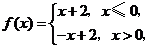 则不等式
则不等式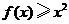 的解集为( )
的解集为( )
A.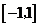 B.
B.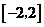 C.
C.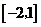 D.
D.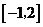
7.(2008陕西理)定义在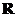 上的函数
上的函数 满足
满足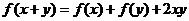 (
(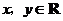 ),
),
 ,则
,则 等于( )
等于( )
A.2 B.3 C.6 D.9
8(2007四川文、理)函数f(x)=1+log2x与g(x)=2-x+1在同一直角坐标系下的图象大致是( )
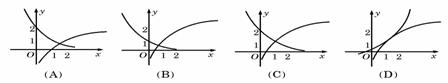
6.(2006北京理)已知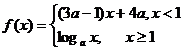 是
是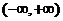 上的减函数,那么
上的减函数,那么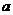 的取值范围是( )
的取值范围是( )
(A)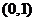 (B)
(B)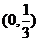 (C)
(C)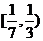 (D)
(D)
5.(2006江西文、理)若不等式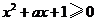 对一切
对一切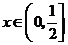 成立,则
成立,则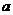 的最小值为( )
的最小值为( )
A.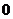 B.
B.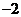 C.
C. D.
D.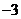
4.(2007山东文)设函数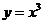 与
与 的图象的交点为
的图象的交点为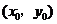 ,则
,则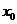 所在的区间是( )
所在的区间是( )
A. B.
B.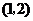 C.
C.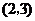 D.
D.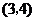
3.(2005山东文科)下列大小关系正确的是( )
A.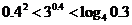 ; B.
; B.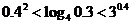 ;
;
C.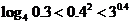 ; D.
; D.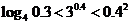
1.(2008全国Ⅰ卷文) 函数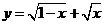 的定义域为( )
的定义域为( )
A.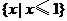 B.
B.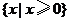 C.
C.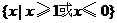 D.
D.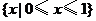
2(2007全国Ⅱ理)把函数y=ex的图象按向量a=(2,3)平移,得到y=f(x)的图象,则f(x)=( )
(A) ex-3+2 (B) ex+3-2 (C) ex-2+3 (D) ex+2-3
21. (09年江苏化学·18)(10分)二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。与Cl2相比,ClO2不但具有更显著地杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
(09年江苏化学·18)(10分)二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。与Cl2相比,ClO2不但具有更显著地杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
 (1)在ClO2的制备方法中,有下列两种制备方法:
(1)在ClO2的制备方法中,有下列两种制备方法:
 方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
 方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O
 用方法二制备的ClO2更适合用于饮用水的消毒,其主要原因是
。
用方法二制备的ClO2更适合用于饮用水的消毒,其主要原因是
。
 (2)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2-).2001年我国卫生部规定,饮用水ClO2-的含量应不超过0.2 mg·L-1。
(2)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2-).2001年我国卫生部规定,饮用水ClO2-的含量应不超过0.2 mg·L-1。
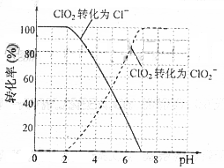
 饮用水中ClO2、ClO2-的含量可用连续碘量法进行测定。ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH的关系如右图所示。当pH≤2.0时,ClO2-也能被I-
饮用水中ClO2、ClO2-的含量可用连续碘量法进行测定。ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH的关系如右图所示。当pH≤2.0时,ClO2-也能被I-

 完全还原成Cl-。反应生成的I2用标准Na2S2O3溶液滴定:2Na2S2O3+I2=Na2S4O6+2NaI
完全还原成Cl-。反应生成的I2用标准Na2S2O3溶液滴定:2Na2S2O3+I2=Na2S4O6+2NaI
 ① 请写出pH≤2.0时,ClO2-与I-反应的离子方程式
。
① 请写出pH≤2.0时,ClO2-与I-反应的离子方程式
。
 ②请完成相应的实验步骤:
②请完成相应的实验步骤:
 步骤1:准确量取VmL水样加入到锥形瓶中。
步骤1:准确量取VmL水样加入到锥形瓶中。
 步骤2:调节水样的pH为7.0~8.0
步骤2:调节水样的pH为7.0~8.0
 步骤3:加入足量的KI晶体。
步骤3:加入足量的KI晶体。
 步骤4:加少量淀粉溶液,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1mL。
步骤4:加少量淀粉溶液,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1mL。
 步骤5: 。
步骤5: 。
 步骤6;再用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。
步骤6;再用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。
 ③根据上述分析数据,测得该引用水样中的ClO2-的浓度为 mg·L-1(用含字母的代数式表示)。
③根据上述分析数据,测得该引用水样中的ClO2-的浓度为 mg·L-1(用含字母的代数式表示)。
 ④若饮用水中ClO2-的含量超标,可向其中加入适量的,该反应的氧化产物是 (填化学式)
④若饮用水中ClO2-的含量超标,可向其中加入适量的,该反应的氧化产物是 (填化学式)
 答案:
答案:
(1)方法二制备的ClO2中不含Cl2
 (2)①ClO2-+4H++4I-=Cl-+2I2+2H2O
(2)①ClO2-+4H++4I-=Cl-+2I2+2H2O
 ②调节溶液的pH≤2.0
②调节溶液的pH≤2.0
 ③
③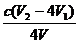
 ④Fe(OH)3
④Fe(OH)3

 解析:(1)比较简单,观察两组方程式,看看产物结合其性质即能得出答案。(2)pH≤2.0时,ClO2-也能被I-
解析:(1)比较简单,观察两组方程式,看看产物结合其性质即能得出答案。(2)pH≤2.0时,ClO2-也能被I- 完全还原成Cl-,那么I-要被氧化为碘单质,溶液是酸性溶液即可正确写出离子方程式。题目信息提示用的是连续碘量法进行测定,步骤6又用Na2S2O3溶液滴定至终点,说明步骤5中有碘生成,结合① 请写出pH≤2.0时,ClO2-与I-反应的离子方程式与pH为7.0~8.0的溶液中存在ClO-可以判断调节溶液的pH≤2.0
完全还原成Cl-,那么I-要被氧化为碘单质,溶液是酸性溶液即可正确写出离子方程式。题目信息提示用的是连续碘量法进行测定,步骤6又用Na2S2O3溶液滴定至终点,说明步骤5中有碘生成,结合① 请写出pH≤2.0时,ClO2-与I-反应的离子方程式与pH为7.0~8.0的溶液中存在ClO-可以判断调节溶液的pH≤2.0 。求引用水样中的ClO2-的浓度可以用关系式法以碘单质为桥梁正确的找准ClO2-与Na2S2O3的关系。Fe2+将ClO2-还原成Cl-,Fe2+被氧化为铁离子,结合反应物不难得出答案
。求引用水样中的ClO2-的浓度可以用关系式法以碘单质为桥梁正确的找准ClO2-与Na2S2O3的关系。Fe2+将ClO2-还原成Cl-,Fe2+被氧化为铁离子,结合反应物不难得出答案

 [考点分析]关注题目给与的信息从题目中挖掘有用的信息,注意关键词如本题的连续碘量法。
[考点分析]关注题目给与的信息从题目中挖掘有用的信息,注意关键词如本题的连续碘量法。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com