
5.化学平衡
(1)化学反应速率:aA(g)+bB(g)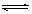 cC(g)+dD(g)
cC(g)+dD(g)
反应任一时刻:v(A)正∶v(B)正∶v(C)正∶v(D)正=a∶b∶c∶d
v(A)逆∶v(B)逆∶v(C)逆∶v(D)逆=a∶b∶c∶d
平衡时:v(A)正=v(A)逆,v(B)正=v(B)逆,v(C)正=v(C)逆,v(D)正=v(D)逆
(2)外界条件对化学反应速率的影响
① 固体物质的浓度可以视作常数,故其反应速率与固体的用量无关。
② 一般温度每升高10℃,反应速率增大2-4倍。
③ 压强只影响气体反应的速率。
④ 充入“惰性气体”:恒温、恒容:不影响反应速率;
恒温、恒压:反应速率减小。
⑤ 催化剂可同等程度的改变正、逆反应速率,影响反应到达平衡的时间,而不能改变反应物的平衡转化率。
(2)平衡常数(K):只与温度有关,温度一定,K为定值。常用于判断平衡移动的方向和平衡时组分浓度、反应物平衡转化率等的计算(计算时特别注意平衡常数表达式中使用的是组分的平衡浓度)。
(3)平衡标志
① 宏观:各组分的浓度相等。
③ 微观:用同一种物质表示的正、逆反应速率相等。
③ 其他:如气体颜色、反应物转化率、产物产率、组分百分含量、气体密度、气体相对分子质量等,若平衡移动时该量改变,则不再改变时即达平衡状态。
(4)平衡移动方向
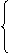 v正>v逆,平衡正向移动
v正>v逆,平衡正向移动
① 改变条件的瞬间: v正=v逆,平衡不移动
v正<v逆,平衡逆向移动
因此,化学平衡的移动与反应的过程有关,是过程函数,化学平衡移动的方向取决于改变条件瞬间的v正、v逆之间的关系。
② 浓度熵(Q)法:按平衡常数计算式算出改变条件的瞬间值,然后与平衡常数进行比较。
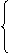 Q<K,平衡正向移动
Q<K,平衡正向移动
改变条件的瞬间: Q=K,平衡不移动
Q>K,平衡逆向移动
(5)等效平衡
① 恒温恒容条件下,当把反应物和生成物换算成一边物质后,若物质的量相等,达平衡时的状态与原平衡等效,此时各组分浓度和百分含量均相等;若反应前后气体体积不变,当把反应物和生成物换算成一边物质后,物质的量与原平衡等比例,达平衡时状态与原平衡等效,此时各组分浓度不等,百分含量相等。
② 恒温恒压条件下,当把反应物和生成物换算成一边物质后,物质的量与原平衡等比例,达平衡时状态与原平衡等效,此时各组分浓度和百分含量均相等。
③ 等效平衡的构建:当增加恒容容器中气体组分的物质的量时,该组分的物质的量浓度瞬间增大,同时由于容器中气体物质的量的增加,使容器内压强增大,两个因素同时影响化学平衡,需构建等效平衡来比较转化率、产率、气体相对分子质量等状态量。
一般思路为:先构建恒温恒压下等效平衡(即反应容器与气体物质的量作同等程度的改变),然后改变容器内压强使容器体积与原平衡时相同,通过压强改变时平衡的移动情况对转化率、产率、气体相对分子质量等状态量的影响作出判断。
注意:构建的等效平衡只能判断气体转化率、产率、相对分子质量等状态量,而不能判断平衡移动的方向。平衡移动是过程函数,应通过改变条件瞬间正、逆反应速率间关系或浓度熵与平衡常数间关系来判断平衡移动的方向。
4.元素周期率与元素周期表
(1)判断金属性或非金属性的强弱
|
金属性强弱 |
非金属性强弱 |
|
①最高价氧化物水化物碱性强弱 |
①最高价氧化物水化物酸性强弱 |
|
②与水或酸反应,置换出H2的易难 |
②与H2化合的易难或生成氢化物稳定性 |
|
③活泼金属能从盐溶液中置换出不活泼金属 |
③活泼非金属单质能置换出较不活泼非金属单质 |
(2)比较微粒半径的大小
①核电荷数相同的微粒,电子数越多,则半径越大:阳离子半径<原子半径<阴离子半径
如:H+<H<H–;Fe>Fe2+>Fe3+;Na+<Na;Cl<Cl–
②电子数相同的微粒,核电荷数越多则半径越小.即具有相同电子层结构的微粒,核电荷数越大,则半径越小。
如:① 与He电子层结构相同的微粒:H–>Li+>Be2+
② 与Ne电子层结构相同的微粒:O2–>F–>Na+>Mg2+>Al3+
③ 与Ar电子层结构相同的微粒: S2–>Cl–>K+>Ca2+
③电子数和核电荷数都不同的微粒
同主族:无论是金属还是非金属,无论是原子半径还是离子半径从上到下递增。
同周期:原子半径从左到右递减。
同周期元素的离子半径比较时要把阴阳离子分开。同周期非金属元素形成的阴离子半径大于金属元素形成的阳离子半径。
例如:Na+<Cl–;第三周期,原子半径最小的是Cl,离子半径最小的是Al3+
(3)元素周期结构

(4)位、构、性间关系

3.热化学方程式
(1)△H=生成物总能量-反应物总能量
=反应物中的总键能-生成物中的总键能
注意:①同一热化学方程式用不同计量系数表示时,△H值不同;②热化学方程式中计量系数表示物质的量;③能量与物质的凝聚状态有关,热化学方程式中需标明物质的状态;④△H中用“+”表示吸热;用“-”表示放热;⑤计算1 mol物质中所含化学键数目时,应首先区分晶体类型,分子晶体应看其分子结构(如P4中含6个P-P键,C60中含30个C=C键和60个C-C键),原子晶体应看其晶体结构,特别注意化学键的共用情况(如1 mol SiO2中含4 mol Si-O键,1 mol 晶体Si中含2 mol Si-Si键);⑥在表示可燃物燃烧热的热化学方程式中,可燃物前系数为1,并注意生成的水为液态。
(2)物质分子所含化学键的键能越大,则成键时放出的能量越多,物质本身的能量越低,分子越稳定。
(3)盖斯定律:一定条件下,某化学反应无论是一步完成还是分几步完成,反应的热效应相同。即反应热只与反应的始态和终态有关,而与反应所经历的途径无关(注意:进行相关计算时,热量应带“+”、“-”进行运算)。
例如: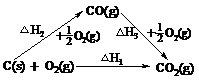 ,△H1=△H2+△H3
,△H1=△H2+△H3
2.离子共存问题
(1)弱碱阳离子只存在于酸性较强的溶液中:Fe3+、Al3+、Zn2+、Cu2+、NH4+、Ag+ 等均与OH–不能大量共存。
(2)弱酸阴离子只存在于碱性溶液中:CH3COO–、F–、CO32–、SO32–、S2–、PO43–、 AlO2–均与H+不能大量共存。
(3)弱酸的酸式阴离子在酸性较强或碱性较强的溶液中均不能大量共存。它们遇强酸(H+)会生成弱酸分子;遇强碱(OH–)会生成正盐和水:HSO3–、HCO3–、HS–、H2PO4–、HPO42–等。
(4)若阴、阳离子能相互结合生成难溶或微溶性的盐,则不能大量共存:Ba2+、Ca2+与CO32–、SO32–、PO43–、SO42–等;Ag+与Cl–、Br–、I– 等;Ca2+与F–,C2O42–等。
(5)若阴、阳离子发生双水解反应,则不能大量共存:Al3+与HCO3–、CO32–、HS–、S2–、AlO2–等;Fe3+与HCO3–、CO32–、AlO2–等。
(6)若阴、阳离子能发生氧化还原反应则不能大量共存:Fe3+与I–、S2–;MnO4–(H+)与I–、Br–、Cl–、S2–、SO32–、Fe2+等;NO3–(H+)与I–、S2–、SO32–、Fe2+等;ClO–与I–、S2–、SO32–等。
(7)因络合反应或其它反应而不能大量共存:Fe3+与SCN–;Al3+与F–等(AlF63–)。
(8)此外,还有与Al反应反应产生氢气的溶液(可能H+;可能OH–,含H+时一定不含NO3–);水电离出的c(H+)=10–13 mol/L(可能为酸溶液或碱溶液)等。
1.阿伏加德罗常数
(1)条件问题:常温、常压下气体摩尔体积增大,不能使用22.4 L/mol。
(2)状态问题:标准状况时,H2O、N2O4、碳原子数大于4的烃为液态或固态;SO3、P2O5等为固态,不能使用22.4 L/mol。
(3)特殊物质的摩尔质量及微粒数目:如D2O、18O2、H37Cl等。
(4)某些特定组合物质分子中的原子个数:如Ne、O3、P4等。
(5)某些物质中的化学键数目:如白磷(31 g白磷含1.5 mol P-P键)、金刚石(12 g金刚石含2 mol C-C键)、晶体硅及晶体SiO2(60 g二氧化硅晶体含4 mol Si-O键)、Cn(1 mol Cn含n mol单键,n/2 mol 双键)等。
(6)某些特殊反应中的电子转移数目:如Na2O2与H2O、CO2的反应(1 mol Na2O2转移1 mol电子;Cl2与H2O、NaOH的反应(1 mol Cl2转移1 mol电子。若1 mol Cl2作氧化剂,则转移2 mol电子);Cu与硫的反应(1 mol Cu反应转移1 mol电子或1 mol S反应转移2 mol电子)等。
(7)电解质溶液中因微粒的电离或水解造成微粒数目的变化:如强电解质HCl、HNO3等因完全电离,不存在电解质分子;弱电解质CH3COOH、HClO等因部分电离,而使溶液中CH3COOH、HClO浓度减小;Fe3+、Al3+、CO32–、CH3COO–等因发生水解使该种粒子数目减少;Fe3+、Al3+、CO32–等因发生水解反应而使溶液中阳离子或阴离子总数增多等。
(8)由于生成小分子的聚集体(胶体)使溶液中的微粒数减少:如1 mol Fe3+形成Fe(OH)3胶体时,微粒数目少于1 mol。
(9)此外,还应注意由物质的量浓度计算微粒时,是否告知了溶液的体积;计算的是溶质所含分子数,还是溶液中的所有分子(应考虑溶剂水)数;某些微粒的电子数计算时应区分是微粒所含的电子总数还是价电子数,并注意微粒的带电情况(加上所带负电荷总数或减去所带正电荷总数)。
3.根据下面一段文字,概括说明什么是“洼地效应”(不超过30个字)。(4分)
区域竞争的焦点更多的集中在综合环境的竞争上。这里的“环境”既包括政务环境、市场环境、法制环境、人文环境等“软环境”,也包括绿化覆盖率、空气质量、居住条件、基础设施水平等“硬环境”。谁的环境好,“洼池效应”就明显,吸引力就强,项目、资金、技术、人才等生产要素聚集就快,发展就快。
“洼地效应”指:

7.根据语境,在下面空格中补写妈妈说的话,要求语言表达鲜明、得体。(不超过50字)(5分)
儿子:妈妈,今天我捡到50元钱,想分五次交给老师。
妈妈:为什么不一次上交呢?
儿子:老师说过,捡到东西上交,就有一次品德加分,我分五次交,就会有五次加分了。
妈妈:□□□□□□□□□□□□□□□□□□□□□□□□□□□□□□□□□□□□□□□□□□□□□□□□□□□□
[答案]略
[考点]考查语言的鲜明、得体,能力层级为D级。
[解析]“准确、鲜明、生动”是大纲地区2008年新增的考点,以与课标地区考点一致。“鲜明”是说要主题鲜明、话题集中;“得体”是说要符合母子对话的身份、特定语境。
[思路分析]根据一定的语境及提示,写出相关内容,使所补写内容与原有内容水乳相融,天衣无缝。要根据题目所给显性要求与语境所给隐性要求(儿子为何分五次,仅仅是加操行分吗?)仔细思考,表达要注意围绕中心,紧扣语境。这种具有一定开放性又有一段限制性的题目,很能考查出考生的语文能力,值得重视。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com