
5.有机中常见的分离和提纯
(1)除杂(括号内为杂质)
① C2H6(C2H4、C2H2):溴水,洗气(或依次通过酸性高锰酸钾溶液、NaOH溶液,洗气)
② C6H6(C6H5-CH3):酸性高锰酸钾溶液、NaOH溶液,分液
③ C2H5-Br(Br2):Na2CO3溶液,分液(主要考虑C2H5Br在NaOH条件下能水解)
④ C6H5-Br(Br2):NaOH溶液,分液
⑤ C2H5-OH(H2O):加新制生石灰,蒸馏
⑥ C6H6(C6H5-OH):NaOH溶液,分液(或直接蒸馏)
⑦ CH3COOC2H5(CH3COOH、C2H5OH):饱和碳酸钠溶液,分液
⑧ C2H5OH(CH3COOH):NaOH,蒸馏
(2)分离
① C6H6、C6H5OH:NaOH溶液,分液,上层液体为苯;然后在下层液体中通过量的CO2,分液,下层液体为苯酚(或蒸馏收集不同温度下的馏分)
② C2H5OH、CH3COOH:NaOH,蒸馏收集C2H5OH;然后在残留物中加硫酸,蒸馏得CH3COOH。
4.官能团间的演变

3.反应条件和反应试剂对有机反应的影响
(1)反应条件
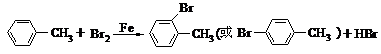 (催化剂时苯环上取代)
(催化剂时苯环上取代)
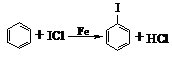
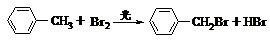 (光照或加热时饱和碳上取代)
(光照或加热时饱和碳上取代)
CH2=CH-CH3+Cl2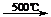 CH2=CH-CH2-Cl+HCl
CH2=CH-CH2-Cl+HCl
CH2=CH-CH3+HBr
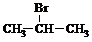 (氢加在含氢较多碳原子上,符合马氏规则)
(氢加在含氢较多碳原子上,符合马氏规则)
CH2=CH-CH3+HBr CH3-CH2-CH2-Br(反马氏加成)
CH3-CH2-CH2-Br(反马氏加成)
(2)温度不同
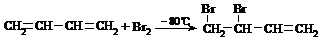
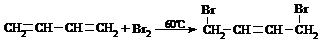
2CH3CH2OH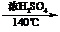 CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
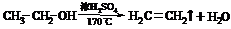
(2)溶剂影响
CH3CH2Br+NaOH CH3CH2OH CH3CH2Br+NaOH
CH3CH2OH CH3CH2Br+NaOH CH2=CH2↑+NaBr+H2O
CH2=CH2↑+NaBr+H2O
(3)试剂浓度影响
CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O CH3COOH+CH3CH2OH
CH3COOH+CH3CH2OH
(3)溶液酸碱性影响
R-OH+HX R-X+H2O R-X+H2O
R-X+H2O R-X+H2O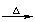 R-OH+HX
R-OH+HX
CH3COOCH2CH3+H2O CH3COOH+CH3CH2OH
CH3COOH+CH3CH2OH
CH3COOCH2CH3+NaOH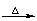 CH3COONa+CH3CH2OH
CH3COONa+CH3CH2OH
2.常见试剂的常见反应
(1)溴单质
 ①
只能是液溴: 与饱和碳原子上氢的取代反应(光照或加热)
①
只能是液溴: 与饱和碳原子上氢的取代反应(光照或加热)
与苯环上氢的取代反应(催化剂)
 ②
可以是溴水(或溴的四氯化碳溶液): 不饱和烃(烯烃或炔烃)的加成反应
②
可以是溴水(或溴的四氯化碳溶液): 不饱和烃(烯烃或炔烃)的加成反应
酚类物质中苯环上的取代反应
含醛基物质的氧化反应
(2)NaOH
 ① NaOH水溶液: 卤代烃的取代反应(1 mol与苯环直接相连的卤原子水解需2 mol NaOH)
① NaOH水溶液: 卤代烃的取代反应(1 mol与苯环直接相连的卤原子水解需2 mol NaOH)
酯的水解反应(1 mol 酚酯消耗2 mol NaOH)
与羧酸或酚羟基的中和反应
蛋白质或多肽的水解
② NaOH醇溶液:卤代烃的消去反应
 (3)新制Cu(OH)2悬浊液: 与羧酸的反应
(3)新制Cu(OH)2悬浊液: 与羧酸的反应
含醛基物质的氧化反应
(4)银氨溶液:含醛基物质的氧化反应
 (5)H2SO4:
作催化剂:苯的硝化或醇的消去反应;酯或蛋白质的水解反应
(5)H2SO4:
作催化剂:苯的硝化或醇的消去反应;酯或蛋白质的水解反应
反应物:苯的磺化反应;与醇的酯化反应
强酸性:与CH3COONa加热蒸馏制CH3COOH
 (6)酸性高锰酸钾: 烯烃、炔烃等不饱和烃的氧化反应
(6)酸性高锰酸钾: 烯烃、炔烃等不饱和烃的氧化反应
苯环侧链(与苯环相连的第一个碳上有氢)的氧化反应
醇的氧化反应
含醛基物质的氧化反应
(7)FeCl3:含酚羟基物质的显色反应
 (8)HNO3:
苯的硝化反应(苯与浓硫酸、浓硝酸的混酸反应)
(8)HNO3:
苯的硝化反应(苯与浓硫酸、浓硝酸的混酸反应)
遇蛋白质显黄色(蛋白质分子中含苯环
与甘油、纤维素等的酯化反应
1.三类物质中氢的活泼性比较
|
|
Na(置换) |
NaOH(中和) |
Na2CO3 |
NaHCO3 |
|
C2H5-OH |
H2↑ |
-- |
-- |
-- |
|
C6H5-OH |
H2↑ |
C6H5ONa |
NaHCO3
|
-- |
|
CH3COOH |
H2↑ |
CH3COONa |
CO2↑ |
CO2↑ |
4.一些特殊类型的反应
(1)化合物+单质 化合物+化合物
化合物+化合物
Cl2+H2O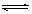 HCl+HClO 2H2S+3O2
HCl+HClO 2H2S+3O2 2SO2+2H2O
2SO2+2H2O
4NH3+5O2 4NO+6H2O CH4+2O2
4NO+6H2O CH4+2O2 CO2+2H2O
CO2+2H2O
(2)化合物+化合物 化合物+单质
化合物+单质
4NH3+6NO 5N2+6H2O 2H2S+SO2
5N2+6H2O 2H2S+SO2 3S+2H2O
3S+2H2O
2Na2O2+2H2O 4NaOH+O2↑
NaH+H2O
4NaOH+O2↑
NaH+H2O NaOH+H2↑
NaOH+H2↑
2Na2O2+2CO2 2Na2CO3+O2 CO+H2O
2Na2CO3+O2 CO+H2O CO2+H2
CO2+H2
(3)一些特殊化合物与水的反应
①
金属过氧化物:2Na2O2+2H2O 4NaOH+O2↑
4NaOH+O2↑
②
金属氮化物:Mg3N2+3H2O 3Mg(OH)2+2NH3↑
3Mg(OH)2+2NH3↑
③
金属硫化物:Al2S3+6H2O 2Al(OH)3+3H2S↑
2Al(OH)3+3H2S↑
CaS+2H2O Ca(OH)2+H2S↑
Ca(OH)2+H2S↑
④
金属碳化物:CaC2+2H2O Ca(OH)2+C2H2↑
Ca(OH)2+C2H2↑
Al4C3+12H2O 4Al(OH)3+3CH4↑
4Al(OH)3+3CH4↑
⑤ 金属氢化物:NaH+H2O NaOH+H2↑
NaOH+H2↑
⑥ 金属磷化物:Ca3P2+6H2O 3Ca(OH)2+2PH3↑
3Ca(OH)2+2PH3↑
⑦ 非金属的卤化物:NCl3+3H2O NH3+3HClO PCl3+3H2O
NH3+3HClO PCl3+3H2O H3PO3+3HCl
H3PO3+3HCl
SiCl4+3H2O H2SiO3+4HCl
SOCl2+H2O
H2SiO3+4HCl
SOCl2+H2O 2HCl+SO2↑
2HCl+SO2↑
(4)双水解反应
① Al3+(或Fe3+)与HCO3–、CO32–:Al3++3HCO3– Al(OH)3↓+3CO2↑
Al(OH)3↓+3CO2↑
2Al3++3CO32–+3H2O 2Al(OH)3↓+3CO2↑
2Al(OH)3↓+3CO2↑
② Al3+与HS–、S2–:Al3++3HS–+3H2O Al(OH)3↓+3H2S↑
Al(OH)3↓+3H2S↑
2Al3++3S2–+6H2O 2Al(OH)3↓+3H2S↑
2Al(OH)3↓+3H2S↑
③ Al3+与AlO2–:Al3++3AlO2–+6H2O 4Al(OH)3↓
4Al(OH)3↓
(5)一些高温下的反应
3Fe+4H2O Fe3O4+4H2↑ 2Al+Fe2O3
Fe3O4+4H2↑ 2Al+Fe2O3 2Fe+Al2O3
2Fe+Al2O3
C+H2O CO+H2
CaCO3
CO+H2
CaCO3 CaO+CO2↑
CaO+CO2↑
CaCO3+SiO2 CaSiO3+CO2↑ Na2CO3+SiO2
CaSiO3+CO2↑ Na2CO3+SiO2 Na2SiO3+CO2↑
Na2SiO3+CO2↑
(6)能连续被氧化的物质
①
单质:Na Na2O
Na2O Na2O2 C
Na2O2 C CO
CO CO2
CO2
N2 NO
NO NO2 P
NO2 P P2O3
P2O3 P2O5 S
P2O5 S SO2
SO2 SO3
SO3
②
化合物:CH4 CO
CO CO2
NH3
CO2
NH3 NO
NO NO2
NO2
H2S S(或SO2)
S(或SO2) SO2
SO2 SO3
CH3CH2O
SO3
CH3CH2O CH3CHO
CH3CHO CH3COOH
CH3COOH
CH3OH HCHO
HCHO HCOOH
HCOOH CO2
CO2
3.有一些特别值得注意的反应
(1)单质+化合物1 化合物2
化合物2
2FeCl2+Cl2 2FeCl3
4Fe(OH)2+O2+2H2O
2FeCl3
4Fe(OH)2+O2+2H2O 4Fe(OH)3
4Fe(OH)3
2Na2SO3+O2 2Na2SO4
2FeCl3+Fe
2Na2SO4
2FeCl3+Fe 3FeCl2
3FeCl2
(2)难溶性酸、碱的分解
H2SiO3 SiO2+H2O Mg(OH)2
SiO2+H2O Mg(OH)2 MgO+H2O
MgO+H2O
2Fe(OH)3 Fe2O3+3H2O 2Al(OH)3
Fe2O3+3H2O 2Al(OH)3 Al2O3+3H2O
Al2O3+3H2O
(3)不稳定性酸、碱的分解
2HClO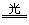 2HCl+O2↑ 4HNO3
2HCl+O2↑ 4HNO3 4NO2↑+O2↑+2H2O
4NO2↑+O2↑+2H2O
NH3·H2O NH3↑+H2O H2SO3
NH3↑+H2O H2SO3 SO2↑+H2O
SO2↑+H2O
(4)不稳定性盐的分解
NH4Cl NH3↑+HCl↑
2AgBr
NH3↑+HCl↑
2AgBr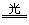 2Ag+Br2
2Ag+Br2
CaCO3 CaO+CO2↑ 2NaHCO3
CaO+CO2↑ 2NaHCO3 Na2CO3+CO2↑+H2O;
Na2CO3+CO2↑+H2O;
(5)金属置换金属:Fe+Cu2+ Cu+Fe2+、2Al+Fe2O3
Cu+Fe2+、2Al+Fe2O3 2Fe+Al2O3
2Fe+Al2O3
(6)金属置换非金属:2Na+2H2O 2NaOH+H2↑
Zn+2H+
2NaOH+H2↑
Zn+2H+ Zn2++H2↑
Zn2++H2↑
2Mg+CO2 2MgO+C 3Fe+4H2O
2MgO+C 3Fe+4H2O Fe3O4+4H2↑
Fe3O4+4H2↑
(7)非金属置换非金属:2F2+2H2O 4HF+O2 Cl2+H2S(HBr、HI)
4HF+O2 Cl2+H2S(HBr、HI) 2HCl+S(Br2、I2)
2HCl+S(Br2、I2)
2C+SiO2 Si+2CO↑ C+H2O
Si+2CO↑ C+H2O CO+H2
CO+H2
3Cl2+2NH3 N2+6HCl
Si+4HF
N2+6HCl
Si+4HF SiF4+2H2
SiF4+2H2
(8)非金属置换金属:H2+CuO Cu+H2O C+2CuO
Cu+H2O C+2CuO 2Cu+CO2↑
2Cu+CO2↑
2.中学化学中的气体
(1)常见气体单质:H2、N2、O2、Cl2
(2)有颜色的气体:Cl2(黄绿色)、溴蒸气(红棕色)、NO2(红棕色)。
(3)易液化的气体:NH3、Cl2、SO2。
(4)有毒的气体:F2、O3、HF、Cl2、H2S、SO2、CO、NO(NO、CO均能与血红蛋白失去携氧能力)、NO2(制备时需在通风橱内进行)。
(5)极易溶于水的气体:NH3、HCl、HBr;易溶于水的气体:NO2、SO2;能溶于水的气体:CO2、Cl2。
(6)具有漂白性的气体:Cl2(潮湿)、O3、SO2。
注意:Cl2(潮湿)、O3因强氧化性而漂白(潮湿Cl2中存在HClO);SO2因与有色物质化合生成不稳定无色物质而漂白;焦碳因多孔结构,吸附有色物质而漂白。
(7)能使石蕊试液先变红后褪色的气体为:Cl2(SO2使石蕊试液显红色)。
(8)能使品红溶液褪色的气体:SO2(加热时又恢复红色)、Cl2(加入AgNO3溶液出现白色沉淀)。
(9)能使无水硫酸铜变蓝的气体:水蒸气。
(10)能使湿润的碘化钾淀粉试纸变蓝的气体:Cl2、Br2、NO2、O3。
(11)不能用浓硫酸干燥的气体:NH3、H2S、HBr、HI。
(12)不能用无水CaCl2干燥的气体:NH3(原因:生成:CaCl2·8NH3)。
1.中学化学中的颜色
(1)焰色反应:Na+(黄色)、K+(紫色,透过蓝色钴玻璃)
(2)有色溶液:Fe2+(浅绿色)、Fe3+(黄色)、Cu2+(蓝色)、MnO4–(紫红色)、Fe(SCN)3(血红色)
(3)有色固体:红色:Cu、Cu2O、Fe2O3;红褐色固体:Fe(OH)3;蓝色固体:Cu(OH)2;黑色固体:CuO、FeO、FeS、CuS、Cu2S、Ag2S、PbS;浅黄色固体:S、Na2O2、AgBr;黄色固体:AgI、Ag3PO4(可溶于稀硝酸);白色固体:Fe(OH)2、CaCO3、BaSO4、AgCl、BaSO3等。
(4)反应中的颜色变化
① Fe2+与OH–反应:产生白色絮状沉淀,迅速转变成灰绿色,最后变成红褐色。
② I2遇淀粉溶液:溶液呈蓝色。
③ 苯酚中加过量浓溴水:产生白色沉淀(三溴苯酚能溶于苯酚、苯等有机物)。
④ 苯酚中加FeCl3溶液:溶液呈紫色。
⑤ Fe3+与SCN–:溶液呈血红色。
⑥ 蛋白质溶液与浓硝酸:出现黄色浑浊(蛋白质的变性)。
6.电解质溶液
(1)溶液的导电性:溶液的导电性取决于溶液中自由移动的离子的浓度及离子所带的电荷数。强电解质溶液的导电性不一定强,相反,弱电解质溶液的导电性不一定弱。
(2)弱电解质的电离程度、能水解盐的水解程度与电解质浓度间的关系:弱酸或弱碱的浓度越大,则其酸性或碱性越强,但其电离程度越小;强酸弱碱盐或弱酸强碱盐的浓度越大,则其酸性或碱性越强,但其水解程度越小。
(3)溶液中微粒浓度的比较
① 微粒浓度的大小比较
首先判断溶液中的溶质;然后根据溶质组成初步确定溶液中微粒浓度间的关系;接着判断溶液的酸、碱性(或题中给出);最后根据溶质是否因电离或水解而造成微粒浓度的变化,根据溶液的酸碱性确定其电离和水解程度的大小,写出微粒浓度间最终的大小关系。
② 微粒浓度间的守恒关系:
电荷守恒:借助于离子浓度(或物质的量)表达溶液呈电中性的式子。
物料守恒:溶液中溶质微粒符合溶质组成的式子。
(4)电极反应式、总化学方程式的书写
① 原电池的负极和电解池的阳极发生氧化反应,还原剂参与,还原剂的还原性越强,
② 当电极产物与电解质溶液中微粒发生反应时,该反应应体现在电极反应式中;当两电极产物会发生反应时,应体现在总反应式中(此时两电极反应式之和并不等于总反应式)。
(5)对可充、放电化学电源的认识
① 放电的方向为原电池方向,是氧化还原反应自发的方向;充电的方向为电解池方向,是氧化还原反应非自发的方向。
② 充电时,原电池的负极(发生氧化反应)接外接电源的负极(作电解池的阴极,发生还原反应);原电池的正极(发生还原反应)接外接电源的正极(作电解池的阳极,发生氧化反应)。
(6)对电解精炼的认识
① 电极材料:阴极为精品,阳极为粗品,电解质溶液为含精炼金属离子的可溶性盐溶液。
② 电极反应式:阳极为精炼金属及活动性位于精炼金属之前的金属失电子而溶解,阴极为精炼金属离子得电子而析出,活动性位于精炼金属之后的金属则掉落而成为阳极泥。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com