
1.臭氧空洞
(1)污染物:CF2Cl2、NOx等
(2)机理:CF2Cl2在高空紫外线作用下产生氯原子,作O3分解的催化剂。NOx直接作O3分解的催化剂。
(3)危害:紫外辐射增强使患呼吸系统传染病的人增加;受到过多的紫外线照射还会增加皮肤癌和白内障的发病率;强烈的紫外辐射促使皮肤老化;使城市内的烟雾加剧,使橡胶、塑料等有机材料加速老化,使油漆褪色等。
4.配合物
Na3AlF6:存在离子键(Na+与AlF63–间)、配位键(Al3+与F–间)。
Ag(NH3)2OH:存在离子键(Ag(NH3)2+与OH–间)、配位键(Ag+与NH3间)。
3.晶体结构与性质--物理性质
(1)晶体类型及其性质
|
|
离子晶体 |
分子晶体 |
原子晶体 |
金属晶体 |
|
组成微粒 |
阴、阳离子 |
分子 |
原子 |
金属离子和自由电子 |
|
微粒间的相互作用 |
离子键 |
分子间作用力 |
共价键 |
金属键 |
|
是否存在单个分子 |
不存在 |
存在 |
不存在 |
不存在 |
|
熔、沸点 |
较高 |
低 |
很高 |
高低悬殊 |
|
硬度 |
较大 |
小 |
很大 |
大小悬殊 |
|
导电情况 |
晶体不导电, 溶于水或熔融状态下导电 |
晶体或熔融状态下不导电, 溶于水时部分晶体能导电 |
晶体为半导体或绝缘体 |
晶体导电 |
 (2)晶体熔、沸点高低的比较
(2)晶体熔、沸点高低的比较
一般规律:原子晶体>离子晶体>分子晶体。
① 离子晶体:离子晶体的晶格能越大,则离子键越强,晶体熔、沸点越高。
晶格能比较:阴、阳离子所带电荷越多,半径越小,则晶格能越大。
例如:MgO>NaCl(Mg2+半径小,所带电荷多)。
FeO>NaCl(Fe2+与Cl–电子层数相同,O2–与Na+电子层数相同,但FeO中离子所带电荷数多)
② 分子晶体:组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越强,晶体的熔、沸点越高。
例如:F2<Cl2<Br2<I2。
此外,当分子形成分子间氢键时,分子晶体的熔、沸点升高。
例如:NH3、H2O、HF的熔、沸点均比同主族下一周期的氢化物来的高。
③ 原子晶体:原子半径越小,键长越短,键能越大,键越牢固,晶体的熔、沸点越高。
例如:金刚石>二氧化硅>金刚砂>晶体硅。
④ 金属晶体:金属离子所带电荷越多,半径越小,金属键越强,晶体的熔、沸点越高。
例如:Na<Mg<Al。
(3)晶体化学式的确定
① 分子结构:分子结构中每一个微粒均属于该分子,按结构中的微粒数书写的式子即为其化学式。
② 晶体结构
分摊法:按晶体结构中各微粒对结构单元的贡献计算出的微粒数目的最简整数比书写的式子即为其化学式。
紧邻法:按晶体结构中各微粒周围与之距离最近且相等的另一微粒数目的最简整数比书写的式子即为其化学式。
(4)金属晶体
① 金属的导电性、导热性和延展性均与自由电子有关。
② 金属晶体的堆积方式
六方堆积(Mg、Zn等):配位数为12;面心立方堆积(Al、Cu等):配位数为12;
体心立方堆积(Na、K等):配位数为8。
2.分子结构与性质
(1)化学键--化学性质(决定分子的稳定性)
|
|
离子键 |
共价键 |
金属键 |
|
成键微粒 |
阴、阳离子 |
原子 |
金属离子和自由电子 |
|
微粒间相互作用 |
静电作用 |
共用电子对 |
静电作用 |
|
成键原因 |
活泼金属(如ⅠA、ⅡA)和活泼非金属(如ⅥA、ⅦA) |
成键原子具有未成对电子 |
金属 |
(2)化学键理论
① 共价键理论(VB):共价键的形成实则是电子的配对。该理论不能解释碳形成甲烷分子。
② 杂化轨道理论:能量相近的轨道可以兼并成能量相同的几个等价轨道。用以解释碳能形成甲烷分子(实则是碳原子采取sp3杂化,形成四个兼并轨道,再与氢成键)。杂化后,原子的成键能力增强。
③ 价层电子对互斥模型
a.分子中的价电子对(包括成键电子对和孤电子对)由于相互排斥,尽可能远离,电子对之间夹角越小,排斥力越大。
b.由于孤电子对只受一个原子核的吸引,电子云比较“肥大”,故电子对之间排斥力大小顺序为:孤电子对与孤电子对大于孤电子对与成键电子对大于成键电子对与成键电子对(因此,均采取sp3杂化,电子对构型都为正四面体形的CH4、NH3、H2O分子中键角依次减小)。
c.微粒中价电子对数为:n=(中心原子的价电子数+每个配位原子提供的价电子数±微粒所带的电荷数)/2(微粒带负电荷时取“+”,带正电荷时取“-”)。主族元素的价电子数等于最外层电子数,氢和卤素作为配位原子时,提供一个电子,当ⅥA族元素作为配位原子时,认为不提供电子(由价电子对数可确定中心原子的杂化形式:电子对数分别为2、3、4时,中心原子分别采取sp、sp2、sp3杂化)。
d.当配位原子不是氢、ⅥA、ⅦA族元素时,可运用等电子原理,寻找其熟悉的等电子体来判断其构型。
④ 等电子原理
a.具有相同原子数目和相同电子总数(或价电子总数)的分子或离子具有相同的结构特征。
b.常见等电子体:N2、CO、CN–、C22–(电子总数为14e–,存在叁键);
CO2、CS2、COS、BeCl2、N3–、OCN–、SCN–(价电子数为16e–,均为直线型);
BCl3、CO32–、SiO32–、NO3–(价电子数为24e–,均为平面正三角形);
NCl3、PCl3、NF3、PF3、SO32–(价电子数为24e–,均为三角锥形);
SiCl4、CCl4、SiO44–、SO42–、PO43–(价电子数为24e–,均为正四面体形)。
(3)分子极性:分子中正、负电荷重心是否重合
①
与键的极性有关;② 与分子的空间构型有关。
|
类型 |
实例 |
键角 |
键的极性 |
空间构型 |
分子的极性 |
|
A2 |
H2、N2、Cl2等 |
― |
非极性键 |
直线形 |
非极性分子 |
|
AB |
HCl、NO、CO等 |
― |
极性键 |
直线形 |
极性分子 |
|
AB2 |
CO2、CS2等 |
180° |
极性键 |
直线形 |
非极性分子 |
|
H2O、H2S等 |
<180° |
极性键 |
“V”形 |
极性分子 |
|
|
SO2分子 |
120° |
极性键 |
三角形 |
极性分子 |
|
|
ABC |
COS |
180° |
极性键 |
直线形 |
极性分子 |
|
AB3 |
BF3分子 |
120° |
极性键 |
三角形 |
非极性分子 |
|
NH3、PCl3等分子 |
<109.5° |
极性键 |
三角锥形 |
极性分子 |
|
|
AB4 |
CH4、CCl4等分子 |
109.5° |
极性键 |
正四面体形 |
非极性分子 |
(4)相似相溶原理:极性相似,相互溶解,极性相差越大,则溶解度越小。
如:水为强极性分子,强极性的HX、NH3等易溶于水;
有机物均为弱极性或非极性分子,有机物间可相互溶解。
(5)共价键的类型
① 电子对是否偏移:极性键和非极性键。
② 成键方式:头碰头--δ键;肩并肩--π键。头碰头时电子云重叠最大,故δ键较π键稳定。当两原子间形成多个共价键时,首先形成一个δ键,其余则只能形成π键。
(6)分子间作用力及氢键--物理性质
① 分子间作用力--范德华力
对于分子组成和结构相似的物质,其相对分子质量越大,范德华力越大,熔、沸点越高。
例如:沸点 F2<Cl2<Br2<I2。
② 氢键
a.形成氢键的因素:含N、O、F,且含有与N、O、F直接相连的H。
b.氢键对物质性质的影响:分子间氢键的形成,使物质在熔化或汽化的过程中,还需克服分子间的氢键,使物质的熔、沸点升高;分子间氢键的形成,可促进能形成氢键的物质之间的相互溶解。
1.原子结构与性质
 原子核:同位素、原子量--物理性质
原子核:同位素、原子量--物理性质
(1)原子(AZX)
核外电子--化学性质
(2)元素的化学性质主要由原子最外层电子数和原子半径决定。
例如:最外层电子数相等,半径不等(同主族元素),性质出现递变性;
Li和Mg、Be和Al的最外层电子数不等,半径相近,性质相似。
(3)原子核外电子排布(掌握1-36号元素)
① 能量最低原理:电子先排能量低的能层和能级,然后由里往外排能量高的(能层和能级均影响电子的能量)。
② 泡里不相容原理:每个原子轨道上最多排2个自旋相反的电子,即原子核外没有2个电子的运动状态完全相同。
③ 洪特规则:电子在能量相同的各个轨道上排布时,电子尽可能分占不同的原子轨道;
当轨道上电子呈半满、全满或全空时,体系能量最低。
(4)电离能比较:首先应写出微粒的外围电子排布式,再根据使体系能量最低去比较;根据用原子的电离能数据也可推测原子的最外层电子数。
(5)电负性:元素的原子吸引电子的能力。元素的电负性越大,则元素的非金属性越强;元素的电负性越小,则元素的金属性越强。电负性相差越大的元素形成化合物时,化合物的离子性越强(形成离子键)。
5.常见离子的检验方法
|
离子 |
检验方法 |
主要现象 |
|||
|
H+ |
酸碱指示剂;活泼金属Zn;碳酸盐等 |
变色,产生氢气,产生CO2气体 |
|||
|
Na+、K+ |
焰色反应 |
钠“黄”钾“紫” |
|||
|
Al3+ |
OH– |
先生成白色沉淀,后白色沉淀溶解形成无色溶液 |
|||
|
Fe3+ |
KSCN溶液,NaOH溶液 |
溶液变红色,生成红褐色沉淀 |
|||
|
NH4+ |
NaOH溶液、加热 |
生成能使湿润的红色石蕊试纸变蓝的气体 |
|||
|
OH– |
酚酞溶液 |
溶液变红色 |
|
|||
|
Cl– |
AgNO3、稀硝酸 |
生成不溶于稀硝酸的白色沉淀 |
|
|||
|
SO42– |
稀HCl、BaCl2溶液 |
生成不溶于HCl的白色沉淀 |
|
|||
|
CO32– |
盐酸、澄清石灰水 |
生成使澄清石灰水变浑浊的无色无味气体 |
|
|||
4.物质的分离和提纯
(1)物质分离提纯的常用方法
|
方法 |
适用范围 |
举例 |
|
过滤 |
分离不溶性固体和液体混合物 |
粗盐提纯时,将粗盐溶于水,过滤除去不溶性杂质 |
|
结晶 |
分离溶解度随温度变化差别大的固体混合物 |
分离KNO3和NaCl的混合物 |
|
蒸发 |
除去溶液中的挥发性溶剂 |
从食盐水中提取食盐 |
|
蒸馏 |
分离沸点差别大的液体混合物 |
由普通酒精制取无水酒精 |
|
萃取 |
提取易溶于某种溶剂的物质 |
用CCl4提取I2水中的I2 |
|
分液 |
分离互不相溶的液体混合物 |
分离水和苯的混合物 |
(2)物质分离提纯的常用化学方法
①溶解法:利用特殊的溶剂(或试剂)把杂质溶解而除去,或提取出被提纯物质的一种方法。
②沉淀法:利用沉淀反应将杂质转化为沉淀而除去,或将被提纯物质转化为沉淀而分离出来。
③转化法:将杂质转化为被提纯物质而除去的一种方法。
④加热分解法:通过加热将杂质转化成气体而除去的一种方法。
⑤酸碱法:通过加酸、碱调节溶液的pH,从而使杂质转化为沉淀而除去。
⑥氧化还原法:通过加氧化剂或还原剂,将杂质转化为气体、沉淀或其它物质而除去。
⑦离子交换法:通过离子交换树脂除去溶液中的特定离子。
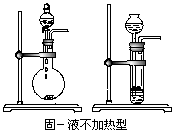
3.常见实验装置
(1)气体发生装置:固、固加热型;固、液不加热型;固(液)、液加热型。
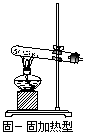


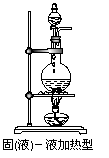

(2)各种防倒吸装置--用于防止液体的倒吸。
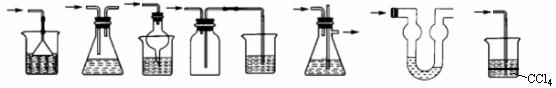
(3)常见的净化装置和尾气吸收装置
① 常见的净化装置--用于除去气体中的杂质气体。

② 常见的尾气吸收装置--用于吸收尾气。

(4)常见的量气装置--通过排液法测量气体的体积。
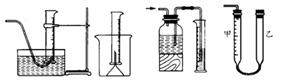
(5)过滤、蒸馏、分液装置


2.中学化学实验中的温度计
(1)测液体的温度:如测物质溶解度;实验室制乙烯等。
(2)测蒸气的温度:如实验室蒸馏石油;测定乙醇的沸点等。
(3)测水浴温度:如温度对反应速率影响的反应;苯的硝化反应;苯的磺化反应;制酚醛树脂;银镜反应;酯的水解等。
1.化学实验中的先与后
(1)加热试管时,应先均匀加热后局部加热。
(2)用排水法收集气体结束时,先移出导管后撤酒精灯。
(3)制取气体时,先检查装置气密性后装药品。
(4)稀释浓硫酸时,应将浓硫酸慢慢注入水中,边加边搅拌。
(5)点燃H2、CH4、C2H4、C2H2等可燃气体时,先检验气体的纯度。
(6)检验卤化烃分子的卤元素时,在水解后的溶液中先加稀HNO3中和碱液再加AgNO3溶液。
(7)检验NH3(用红色石蕊试纸)、Cl2(用淀粉KI试纸)等气体时,先用蒸馏水润湿试纸后再与气体接触。
(8)中和滴定实验时,用蒸馏水洗过的滴定管、移液管先用待装液润洗。
(9)焰色反应实验时,每做一次,铂丝应先沾上稀盐酸放在火焰上灼烧到无色时,再做下一次实验。
(10)H2还原CuO时,先通H2后加热,反应完毕后先撤酒精灯,冷却后再停止通H2。
(11)检验蔗糖、淀粉水解产物时,先加NaOH中和催化作用的硫酸,再加新制Cu(OH)2悬浊液或银氨溶液。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com