
2.(05江西卷)设集合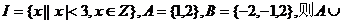 (
(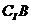 )=(D)
)=(D)
A.{1} B.{1,2} C.{2} D.{0,1,2}
1.(05上海卷)已知集合 ,
,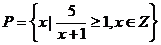 ,则
,则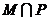 等于
(B)
等于
(B)
A. B.
B.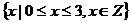
C.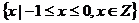 D.
D.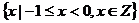
4、考查离子的放电顺序及相关计算
该类试题主要出现在电化学中,因而需要分析粒子放电的位置及先后顺序。
例4、 电解100mL含 c(H+)=0.30mol/L的下列溶液,当电路中通过0.04mol电子时,理论上析出金属质量最大的是( )
A.0.10mol/LAg+ B.0.02mol/L Zn2+
C.0.20mol/L Cu2+ D.0.20mol/L Pb2+
讲析 根据金属活动顺序表可知题中阳离子的放电顺序为Ag+>Cu2+>H+>Pb2+>Zn2+,故当电路中通过0.04mol的电子时,能析出金属的只有选项A和C,根据Ag++e-=Ag和Cu2++2e-=Cu可知,析出的金属的物质的量分别为0.01mol的Ag和0.02mol的Cu,其质量分别为1.08g和1.28g。
答案 C
总之,熟悉掌握物质氧化性或还原性强弱的比较方法,对于我们准确理解或解答氧化还原反应的先后、电化学中的离子放电顺序及推断元素在周期表中的位置等知识具有重要的作用。
3、判断离子方程式的正误
该类试题主要选择题的形式出现,涉及到的离子反应往往是氧化还原反应,因而就需要从氧化性(或还原性)的强弱角度分析反应的先后顺序进而解答问题。
例3(2009全国II)

 含有a mol FeBr2的溶液中,通入x mol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是( )
含有a mol FeBr2的溶液中,通入x mol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是( )

 A.x=0.4a,2Fe2++Cl2=2Fe3++2Cl-
A.x=0.4a,2Fe2++Cl2=2Fe3++2Cl-
 B.x=0.6a,2Br-+ Cl2=Br2+2Cl-
B.x=0.6a,2Br-+ Cl2=Br2+2Cl-

 C.x=a,2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl-
C.x=a,2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl-
 D.x=1.5a,2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-
D.x=1.5a,2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-
 解析:由于Fe2+的还原性强于Br-,故根据氧化还原反应的先后顺序知,Cl2先氧化Fe2+,然后再氧化Br-。2Fe2+ + Cl2
解析:由于Fe2+的还原性强于Br-,故根据氧化还原反应的先后顺序知,Cl2先氧化Fe2+,然后再氧化Br-。2Fe2+ + Cl2  2Fe3+ + 2Cl-,2Br- + Cl2
2Fe3+ + 2Cl-,2Br- + Cl2  Br2 + 2Cl-,2FeBr2 + 3Cl2
Br2 + 2Cl-,2FeBr2 + 3Cl2  2FeCl3 + 2Br2 。当x/a ≤0.5时,Cl2仅氧化Fe2+,故A项正确。当x/a ≥1.5时,Fe2+和Br-合部被氧化,D项正确;当介于两者之间时,则要分步书写方程式,然后进行叠加得总反应。如B项,当x=0.5a时,Cl2刚好把Fe2+全部氧化,而当x=0.6a,显然Cl2还要氧化Br-,而选项中没有表示,故错。
2FeCl3 + 2Br2 。当x/a ≤0.5时,Cl2仅氧化Fe2+,故A项正确。当x/a ≥1.5时,Fe2+和Br-合部被氧化,D项正确;当介于两者之间时,则要分步书写方程式,然后进行叠加得总反应。如B项,当x=0.5a时,Cl2刚好把Fe2+全部氧化,而当x=0.6a,显然Cl2还要氧化Br-,而选项中没有表示,故错。
 答案:B
答案:B
2、判断反应能否进行
该类题目往往以提供陌生信息,然后让学生通过分析提取信息从而解答问题。
例2、已知反应Co2O3+6HCl=2CoCl2+Cl2↑+3H2O、3Cl2+2FeI2=2FeCl3+3I2、2FeCl3+2KI=I2+2FeCl2+2KCl均能进行,请判断下列反应在溶液中不可能发生的是( )
A.Cl2+FeI2=FeCl2+I2 B.3Cl2+6FeI2=2FeCl3+4FeI3
C.I2+2Fe2+=2Fe3++I― D.Co2O3+6H++2I―=I2+2Co2++3H2O
E.Co2O3+6H++2Fe2+=2Fe3++2Co2++3H2O
解析:氧化还原反应是:强氧化剂+强还原剂 弱氧化剂+弱还原剂,或者说氧化性、还原性体现“以强制弱”的原则。故根据三个已知反应可知氧化性顺序为Co2O3>Cl2>FeCl3>I2。Cl2与FeI2反应时,首先是还原性更强的I―反应,因此A反应正确。B、C中由于氧化性Fe3+>I2,因此反应均错误。D、E根据Co2O3>I2,Co2O3>Fe3+,可以确定两反应均正确。
弱氧化剂+弱还原剂,或者说氧化性、还原性体现“以强制弱”的原则。故根据三个已知反应可知氧化性顺序为Co2O3>Cl2>FeCl3>I2。Cl2与FeI2反应时,首先是还原性更强的I―反应,因此A反应正确。B、C中由于氧化性Fe3+>I2,因此反应均错误。D、E根据Co2O3>I2,Co2O3>Fe3+,可以确定两反应均正确。
答案:B、C
1、判断氧化性(或还原性)的强弱
该类题主要以提供已知的氧化还原反应方程式为主,然后根据价态变化分析出氧化剂、还原剂、氧化产物、还原产物后,再利用强弱规律解答即可,一般是比较氧化性时就找氧化剂与氧化产物,比较还原性则找还原剂与还原产物。
例1(2009广东)常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:2Fe2++H2O2+2H+=2Fe3++2H2O,2Fe3++H2O2=2Fe2++O2↑+H+下列说法正确的是( )
A.H2O2的氧化氢比Fe3+强,其还原性比Fe2+弱
B.在H2O2分解过程中,溶液的pH逐渐下降
C.在H2O2分解过程中, Fe2+和Fe3+的总量保持不变
D.H2O2生产过程要严格避免混入Fe2+
解析:由氧化还原反应的强弱律“氧化性是氧化剂大于氧化产物,还原性是还原剂大于还原产物”知由方程一可知中氧化剂H2O2氧化性比氧化产物Fe3+强,方程二中还原剂H2O2还原性比,原产物为Fe2+强,所以A错误;方程一和方程二相加,即H2O2分解生成H2O和O2,H2O2呈弱酸性,所以随着反应进行,pH升高,B错误;H2O2分解Fe3+或Fe2+作催化剂,所以总量不变,C正确;因为Fe2+可导致H2O2分解,所以H2O2生产过程要避免混入Fe2+,D正确。
答案:CD
5、 根据价态越高,氧化性越高判断:含有同种元素的不同物质,一般来说价态越高则其氧化性越强,如氯化铁的氧化性强于氯化亚铁,浓硫酸的氧化性强于亚硫酸。但也有特殊情况,如高氯酸的氧化性弱于次氯酸。
6、 根据被氧化被还原的程度判断:当不同的氧化剂与同一还原剂反应时,还原剂被氧化的程度越大,氧化剂的氧化性就越强。如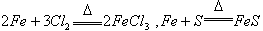 ,根据铁被氧化程度的不同Fe3+、Fe2+ ,可判断氯气氧化性强于硫 。同理,当不同的还原剂与同一氧化剂反应时,氧化剂被还原的程度越大,还原剂的还原性就越强。但出现同一物质还原同一物质时,不能根据氧化剂被还原的程度判断氧化性的强弱,如:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O 、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,虽然稀硝酸的还原程度大,但其氧化性比浓硝酸弱。
,根据铁被氧化程度的不同Fe3+、Fe2+ ,可判断氯气氧化性强于硫 。同理,当不同的还原剂与同一氧化剂反应时,氧化剂被还原的程度越大,还原剂的还原性就越强。但出现同一物质还原同一物质时,不能根据氧化剂被还原的程度判断氧化性的强弱,如:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O 、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,虽然稀硝酸的还原程度大,但其氧化性比浓硝酸弱。
7 根据氧化还原反应的难易程度判断:不同的氧化剂与同一还原剂反应时,反应条件越易,其氧化剂的氧化性越强。如:

前者比后者容易发生反应,可判断氧化性: 。同理,不同的还原剂与同一氧化剂反应时,反应条件越易,其还原剂的还原性越强。
8、影响氧化性或还原性强弱的其它因素:①温度:如热的浓硫酸的氧化性比冷的浓硫酸的氧化性强。②浓度:如浓硝酸的氧化性比稀硝酸的强;③酸碱性:如中性环境中
。同理,不同的还原剂与同一氧化剂反应时,反应条件越易,其还原剂的还原性越强。
8、影响氧化性或还原性强弱的其它因素:①温度:如热的浓硫酸的氧化性比冷的浓硫酸的氧化性强。②浓度:如浓硝酸的氧化性比稀硝酸的强;③酸碱性:如中性环境中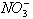 不显氧化性,酸性环境中
不显氧化性,酸性环境中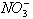 显氧化性;又如
显氧化性;又如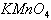 溶液的氧化性随溶液的酸性增强而增强。
溶液的氧化性随溶液的酸性增强而增强。
注意:物质的氧化性或还原性的强弱只决定于得到或失去电子的难易,与得失电子的多少无关。如还原性: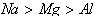 ,氧化性:
,氧化性: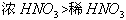 。
。
2、根据金属活动顺序表判断:一般来说,在金属活动顺序中越靠前的金属,其还原性越强,即 。如由铁排在铜的前面知铁的还原性强于铜,由反应Fe+CuSO4=FeSO4+Cu也证明推论正确。但要注意也有例外,如钠能置换出熔化状态氯化钾中的钾。
3、根据元素周期表判断:一般来说,元素的金属性越强,则其单质的还原性越强;元素的非金属性越强,则其单质的氧化性越强,故同一周期元素组成的单质,从左到右,原子半径越来越小,单质的氧化性越来越强,还原性越来越弱;同一主族元素组成的单质,从上到下,原子半径越来越大,单质的氧化性越来越弱,还原性越来越强;如根据元素周期表知:氧元素的非金属性比氟弱,则可推得氧气的氧化性弱于氟气,反应2F2+2H2O=4HF+O2可证明推论正确;氯、溴、碘元素的非金属性依次减弱,则可推知其单质的氧化性依次减弱。但也有例外,如氮元素的非金属性强于氯,但氯气能置换出氨气中的氮。
4、 根据原电池、电解池的电极反应比较:
。如由铁排在铜的前面知铁的还原性强于铜,由反应Fe+CuSO4=FeSO4+Cu也证明推论正确。但要注意也有例外,如钠能置换出熔化状态氯化钾中的钾。
3、根据元素周期表判断:一般来说,元素的金属性越强,则其单质的还原性越强;元素的非金属性越强,则其单质的氧化性越强,故同一周期元素组成的单质,从左到右,原子半径越来越小,单质的氧化性越来越强,还原性越来越弱;同一主族元素组成的单质,从上到下,原子半径越来越大,单质的氧化性越来越弱,还原性越来越强;如根据元素周期表知:氧元素的非金属性比氟弱,则可推得氧气的氧化性弱于氟气,反应2F2+2H2O=4HF+O2可证明推论正确;氯、溴、碘元素的非金属性依次减弱,则可推知其单质的氧化性依次减弱。但也有例外,如氮元素的非金属性强于氯,但氯气能置换出氨气中的氮。
4、 根据原电池、电解池的电极反应比较:
①两种不同金属构成原电池的两极,则还原性:负极>正极。
②用惰性电极电解混合溶液时,在阴极先放电的阳离子的氧化性较强,在阳极先放电的阴离子的还原性较强。
1、根据氧化还原反应方程式判断:
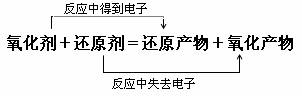
在同一个氧化还原反应中,氧化性:氧化剂>氧化产物,还原性:还原剂>还原产物,这也是判断物质氧化性或还原性强弱最主要、最准确的方法。例;2FeCl3+Cu=2FeCl2+CuCl2 氧化性:Fe3+>Cu2+ 还原性:Cu>Fe2+
11.雨过天晴,人们常看到天空中出现彩虹,它是由阳光照射到空中弥漫的水珠上时出现的现象.在说明这个现象时,需要分析光线射入水珠后的光路.
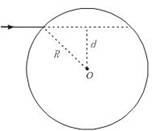 一细束光线射入水珠,水珠可视为一个半径为R的球,球心O到入射光线的垂直距离为d.水的折射率为n.
一细束光线射入水珠,水珠可视为一个半径为R的球,球心O到入射光线的垂直距离为d.水的折射率为n.
(1)在图上画出该束光线射入水珠内经一次反射后又从水珠中射出的光路图.
(2)求这束光线从射向水珠到射出水珠每一次偏转的角度.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com