
3.函数y=x+sinx, 的最大值是 ( )
的最大值是 ( )
A.0 B.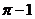 C.
C. D.
D. 
2.若 ,那么
,那么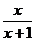 是正数的充要条件是 ( )
是正数的充要条件是 ( )
A. B.
B. C.
C. D.
D. 或
或
1.设A={0,1,-2},B= {b|b=xy,x,y A},则B的子集的个数是 ( )
A},则B的子集的个数是 ( )
A.4 B.8 C.16 D.32
(四)溶液的稀释和混合
1、稀释:溶质在稀释前后质量和物质的量不变。
c1V1=c2V2(c1、c2依次分别为稀释前、后溶液的物质的量浓度,V1、V2为稀释前、后溶液的体积)。
2、混合:相同溶质不同浓度溶液混合,其溶质的物质的量、溶质的质量在混合前后不变。
(1)混合后溶液体积不变:c1V1+c2V2=c混(V1+V2)。
(2)混合后溶液体积改变:c1V1+c2V2=c混V混(V混=m混/ρ混)。
[思考感悟]
将1molNa2O溶于1L水中,所得溶液中溶质的物质的量浓度为1mol·L-1吗?
1molNa2O溶于水生成2molNaOH,其溶质为NaOH而不是Na2O,当1L水中溶解2mol溶质NaOH,其溶液的体积不一定是1L,故溶液的物质的量浓度不一定是1mol·L-1,也不一定是2mol·L-1。
[基础训练]
1、20℃时,饱和KCl溶液的密度为ρg·cm-3,溶液中KCl的质量分数为w,则下列说法不正确的是( C )
A、20℃时,饱和KCl溶液的物质的量浓度为1000ρw/74.5mol·L-1
B、20℃时,KCl的溶解度为100w/(1-w)g
C、20℃时,将1体积的饱和KCl溶液加入到1体积的水中稀释,稀释后溶液中KCl的质量分数为w/2
D、将此溶液蒸发部分水,再恢复到20℃时,溶液的密度不变
2、常温下,将20.0g14%的NaCl溶液跟30.0g24%的NaCl溶液混合,得到密度为1.17g·cm-3的混合溶液。计算:
(1)该混合溶液中NaCl的质量分数。(20%)
(2)该混合溶液中NaCl的物质的量浓度。(4.0mol·L-1)
(3)在1000g水中需加入4.3摩尔氯化钠,才能使其浓度恰好与上述混合溶液浓度相等。(保留1位小数)
3、某溶液中大量存在如下五种离子:NO3-、SO42-、Fe3+、H+、M,它们的物质的量浓度之比依次为c(NO3-)︰c(SO42-)︰c(Fe3+)︰c(H+)︰c(M)=2︰3︰1︰3︰1,则M可能是( B )
A、Al3+ B、Mg2+ C、Fe2+ D、Ba2+
[高考模拟]
4、(2007山东高考)一定体积的KMnO4溶液恰好能氧化一定质量的KHC2O4·H2C2O4·2H2O。若用0.1000mol·L-1的NaOH溶液中和相同质量的KHC2O4·H2C2O4·2H2O,所需NaOH溶液的体积恰好为KMnO4溶液的3倍,则KMnO4溶液的浓度(mol·L-1)为( B )
提示:①H2C2O4是二元弱酸
②10[KHC2O4·H2C2O4]+8KMnO4+17H2SO4=8MnSO4+9K2SO4+40CO2↑+32H2O
A、0.008889 B、0.08000 C、0.1200 D、0.2400
5、(2008朝阳模拟)已知溶解结晶平衡状态是一种动态平衡状态。在一定温度时,往500mL硫酸铜饱和溶液中加入一定量硫酸铜晶体(CuSO4·5H2O),下列说法错误的是( B )
A、溶液中溶质的质量分数不变 B、溶液中溶质的物质的量浓度增大
C、溶液的质量也不改变 D、溶液还是饱和溶液
[作业]
(三)气体溶于水的物质的量浓度的计算
在标准状况下,一定体积气体溶于水后所得溶液物质的量浓度的计算式为:
c=1000ρV气/(MV气+22400V水)。
式中ρ为溶液密度(g·cm-3),M为气体的摩尔质量(g·mol-1),V气为气体体积(L),V水为水的体积(L)。
(二)饱和溶液中溶质的质量分数、物质的量浓度与溶解度的换算
w=S/(100+S)×100%
c=n/V=(S/M)/[(100+S)/1000ρ=1000ρS/M(100+S)(ρ的单位为g·cm-3)。
(一)物质的量浓度与溶质质量分数的换算
某溶液物质的量浓度为cmol·L-1,溶质的质量分数为w,溶液的密度为ρg·cm-3,溶质的摩尔质量为Mg·mol-1,则它们之间的关系为c=1000·ρ·w/M。
(四)应用注意事项
1、溶液的体积不等于溶剂的体积,也不等于溶剂体积与溶质体积的和,必须通过溶液的质量和密度计算之。
2、体积的单位通常用升(L)。
(三)数学表达式:c(B)=n(B)/V(aq)。
(二)符号:c;常用单位:mol·L-1。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com