
14.将饱和三氯化铁溶液滴入沸水时,液体变为__ _____色,得到的是__________,反应的离子方程式为___________。用此分散系进行实验:
_____色,得到的是__________,反应的离子方程式为___________。用此分散系进行实验:
(1)将其装入U形管内,用石墨作电极,接通直接电源,通电一段时间后发现阴极附近颜色________,这表明________________________,这 种现象称为__
种现象称为__ ___________。
___________。
(2)向其中加入饱和的硫酸铵溶液,发生的现象是________________________;原因是___ ______________。
______________。
(3)向其中逐滴加入过量稀硫酸,现象是_________________________;原因是____________________。
(4)提纯此分散系的方法叫_____________________。
13.下面是四种盐在不同温度下的溶解度(g):
|
温度 |
NaNO3 |
KNO3 |
NaCl |
KCl |
|
10℃ |
80.5 |
20.8 |
35.7 |
31.0 |
|
100℃ |
175 |
246 |
39.1 |
56.6 |
(假设:①盐类共存时不影响各自的溶解度;②分离晶体时,溶剂的损耗忽略不计)
某同学设计用物质的量比为1∶1的NaNO3和KCl为原料,加入一定量的水制取KNO3的实验,其流程如下框图所示。

(1)在①和③的实验过程中,关键的实验条件是____ _____。
_____。
(2)分离出晶体的②和④两操作是_______(填倾倒、蒸发、结晶、过滤中的某种操作)。KNO3是晶体_______(A或C)。
(3)粗产品中可能含有的杂质离子是________,检验的方法是_____________________。
(4)将该粗产品提纯,可采取的方法是__________________。
12、生活和生产中常用到胶体的性质,请看下述三例:
(1)做实验时,手指不慎被玻璃划破,可从急救箱中取氯化铁溶液应急止血,其原理是__________________________。
(2)在陶瓷工业上常遇到因陶土里混有氧化铁而影响产品质量。解决方法之一是把这些陶土和水一起搅拌,使微粒直径为10-9 m-10-7 m之间,然后插入两根电极,再接通直流电源。这时,阳极聚集_______________,阴极聚集_______________,理由是___________________________。
(3)水泥和冶金工厂常用高压电对气溶胶作用除去大量烟尘,以减少对空气的污染,这种作用运用了__________原理。
11.(1)20°C时,20mL NaCl饱和溶液质量为24g,将其蒸干后得食盐6.34g,则20°C时,食盐的溶解度为______,此时食盐饱和溶液的质量分数为_________,物质的量浓度为____________。 (2)200mL 0.8mol/L H2SO4溶液(d=1.08g/cm3)和100mL 98%浓硫酸(d=1.84g/cm3)混合,所得H2SO4稀溶液的密度为1.2g/cm3,则混合后稀H2SO4的物质的量浓度为____________。
10、 下图是几种盐的溶解度曲线,下列说法中正确的是
下图是几种盐的溶解度曲线,下列说法中正确的是
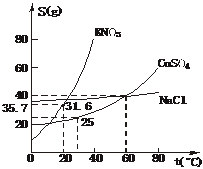
A.40℃时,将35 g食盐溶于100 g水中,降温至0℃时,可析出NaCl晶体
B.20℃时KNO3饱和溶液的溶质 质量分数为31.6%
质量分数为31.6%
C.60℃时,200 g水中溶解80 g CuSO4达饱和,当降温至30℃时,可析出30 g硫酸铜晶体
D.30℃时,将35 g KNO3和35 g NaCl同时溶于100 g水中,蒸发时先析出的晶体是NaCl
9.(新情景题)青霉素试验针用的稀溶液为200国际单位/mL。现有1小瓶20 万国际单位青霉素、1.0 mL 注射器(分刻度为0.1 mL)、注射用水和几个干净小瓶。先吸取1.0 mL注射用水注入第1瓶内溶解青霉素,又吸取0.1 mL溶液在第2小瓶中用水稀释成1.0 mL,再吸取0.1 mL在第3小瓶中稀释成1.0 mL……在第几小瓶中青霉素浓度为200 国际单位/mL
A.3 B.4 C.5 D.6
8.质量分数为a的某物质的溶液m g与质量分数为b的该物质的溶液n g 混合后,蒸发掉p g水。得到的溶液每毫升质量为q g,物质的量浓度为c。则溶质的相对分子质量为为
A .  B.
B. C .
C . D.
D.
7.将标准状况下的NH3(g)溶于水中,得到密度为b g·cm-3的氨水a g,物质的量浓度为c mol·L-1,则溶于水中的NH3(g)的体积是
A.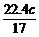 L B.
L B. L C.
L C. L D.
L D. L
L
6. t ℃,将一定质量的某物质的不饱和溶液均分为三份,分别加热蒸发溶液,然后把温度降至t ℃,已知从三份溶液中蒸发的溶剂质量分别为10 g、20 g、30 g,析出晶体(不含结晶水)质量分别为a、b、c(单位g,且a、b、c均大于零),则a、b、c三者的关系为
A.c=2b-a B.c=a+b C.c=a+2b D.c=2a+b
5.20℃时,饱和KCl溶液的密度为1.174 g·cm-3,物质的量浓度为4.0 mol·L-1,则下列说法中不正确的是
A.25℃时,饱和KCl溶液的浓度大于4.0 mol·L-1
B.此溶液中KCl的质量分数为 ×100%
×100%
C.20℃时,密度小于1.174 g·cm-3的KCl溶液是不饱和溶液
D.将此溶液蒸发部分水,再恢复到20℃时,溶液密度一定大于1.174 g·cm-3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com