
2.知道电解在氯碱工业、精炼铜、电镀、电冶金等方面的应用。认识电能转化为化学能的实际意义。
知识梳理
1.通过电能转变为化学能的探究活动,了解电解池工作原理,能正确书写电解池的阴、阳极的电极反应式及电解反应方程式。
2. 原电池的原理
负极----较活泼的金属--- 电子------发生 反应
正极----较不活泼的金属---- 电子----发生 反应
试题枚举
[例1]下列叙述中正确的是
A.构成原电池正极和负极的材料必须是两种金属。
B.由铜、锌作电极与硫酸铜溶液组成的原电池中铜是负极。
C.马口铁(镀锡铁)破损时与电解质溶液接触锡先被腐蚀。
D.铜锌原电池工作时,若有13克锌被溶解,电路中就有0.4mol电子通过。
解析: 两种活动性不同的金属与电解质溶液能够组成原电池,但不能因此说构成原电池电极的材料一定都是金属,例如锌和石墨电极也能跟电解质溶液组成原电池。在原电池中,活动金属中的电子流向不活动的电极,因此活动金属是负极。镀锡铁表皮破损后与电解质溶液组成原电池,铁较锡活泼,铁先失电子被腐蚀。铜锌原电池工作时,锌负极失电子,电极反应为Zn –2e==Zn2+,1molZn失去2mol电子,0.2mol锌(质量为13克)被溶解电路中有0.4mol电子通过。故选D。
答案:D
[例2]把A、B、C、D四块金属泡在稀H2SO4中,用导线两两相连可以组成各种原电池。若A、B相连时,A为负极;C、D相连,D上有气泡逸出;A、C相连时A极减轻;B、D相连,B为正极。则四种金属的活泼性顺序由大到小排列为
A.A>B>C>D B.A>C>B>D C.A>C>D>B D.B>D>C>A
解析:金属组成原电池,相对活泼金属失去电子作负极,相对不活泼金属作正极。负极被氧化质量减轻,正极上发生还原反应,有物质析出,由题意得活泼性 A>B、A>C、C>D 、D>B,故正确答案为B。
答案:B
[例3]电子计算机所用钮扣电池的两极材料为锌和氧化银,电解质溶液为KOH溶液,其电极反应是: Zn + 2 OH- -2e=ZnO + H2O Ag2O +H2O + 2e=2Ag +2 OH-
下列判断正确的是
A.锌为正极,Ag2O为负极。 B.锌为负极,Ag2O为正极。
C.原电池工作时,负极区溶液PH减小。 D.原电池工作时,负极区溶液PH增大。
解析:本题考查原电池和PH的概念。
原电池中失去电子的极为负极,所以锌为负极,Ag2O为正极。B是正确答案。因为 Zn + 2 OH- -2e=ZnO + H2O ,负极区域溶液中[OH-] 不断减少,故PH减小,所以C也正确。故选B、C。
答案:BC
[变式]化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)目前常用的镍(Ni)镉(Cd)电池,其电池总反应可以表示为:Cd+2NiO(OH)+2H2O
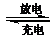 2Ni(OH)2+Cd(OH)2已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,
2Ni(OH)2+Cd(OH)2已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,
以下说法中正确的是
①以上反应是可逆反应 ②以上反应不是可逆反应
③充电时化学能转变为电能 ④放电时化学能转变为电能
A.①③ B.②④ C.①④ D.②③
(2).废弃的镍镉电池已成为重要的环境污染物,有资料表明一节废镍镉电池可以使一平方米面积的耕地失去使用价值。在酸性土壤中这种污染尤为严重。这是因为
。
(3).另一种常用的电池是锂电池(锂是一种碱金属元素,其相对原子质量为7),由于它的比容量(单位质量电极材料所能转换的电量)特别大而广泛应用于心脏起搏器,一般使用时间可长达十年。它的负极用金属锂制成,电池总反应可表示为:Li+MnO2→LiMnO2试回答:锂电池比容量特别大的原因是 。锂电池中的电解质溶液需用非水溶剂配制,为什么这种电池不能使用电解质的水溶液?请用化学方程式表示其原因 。
答案:(1)B (2)Ni(OH)2和Cd(OH)2能溶于酸性溶液。
(3)锂的摩尔质量小;2Li+2H2O→2LiOH+H2↑
电解池原理
考点聚焦
2.能正确书写原电池的正、负极的电极反应式及电池反应方程式。
知识梳理
1:组成原电池的条件。
① 有两种活性不同的金属(或一种是非金属导体)。
② 电极材料均插入电解质溶液中。
③ 两电极相连形成闭合电路。
1.通过进行化学能转化为电能的探究活动,了解原电池工作原理.
①不能与H+共存的离子有 、
②不能与OH-共存的离子有 、
③不能与HCO3-共存的离子有 、
④不能与Al3+共存的离子有 、
⑤不能与AlO2-共存的离子有 、
⑥不能与Fe3+共存的离子有 、
⑦不能与Fe2+共存的离子有 、
⑧不能与ClO-共存的离子有 、
试题枚举
[例1] (2006江苏,13)下列叙述正确的是
A.0.1mol·L-1氨水中,c(OH-)==c(NH4+)
B.10 mL 0.02mol·L-1HCl溶液与10 mL 0.02mol·L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12
C.在0.1mol·L-1CH3COONa溶液中,c(OH-)==c(CH3COOH)+c(H+)
D.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中,c(Na+)==2c(A2-)+c(HA-)+c(H2A)
解析:NH3·H2O是弱电解质,它本身电离所产生的两种离子浓度相等,得氨水中的部分OH-来自于H2O的电离,所以c(OH-)>c(NH4+),A错;B项中酸碱中和反应后,
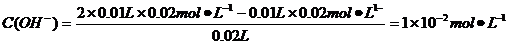
pH=-lgC(H+)=-lg(10-14/10-12)=12,B正确;根据盐的消解规律,可以判断C正确;D项中因钠元素的离子与A原子的物质的量之比为1∶1,对应关系应该为c(Na+)=c(A2-)+c(HA-)+c(H2A),D错。
答案:BC
[例2] (2006四川,12)25℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的PH=7时,下列关系正确的是
A.c(NH4+)==c(SO42-) B.c(NH4+)>c(SO42-)
C.c(NH4+)<c(SO42-) D.c(OH-)+c(SO42-)==c(H+)+c(NH4+)
解析: 氨水与稀硫酸反应,至溶液呈中性,即c(H+)=c(OH-);根据电荷守恒有:c(NH4+)+c(H+)=c(OH-)+2c(SO42-),则D错;将前两个等式融合得, c(NH4+)=2c(SO42-),则A错,B对,C错。
答案: B
[例3] 已知0.1 mol·L-1的二元酸H2A溶液的pH=4.0,则下列说法正确的是( )
A.在Na2A、NaHA两溶液中,离子种类不相同
B.在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-)
D.在Na2A溶液中一定有:c(Na+)>c(A2-)>c(H+)>c(OH-)
解析:0.1 mol·L-1的强酸pH=1.0,0.1
mol·L-1的H2A溶液pH=4.0,说明它是一种弱酸。Na2A发生水解A2-+H2O HA-+OH-和HA-+H2O
HA-+OH-和HA-+H2O H2A+OH-,溶液中存在HA-、A2-、H+、OH-;NaHA发生水解HA-+H2O
H2A+OH-,溶液中存在HA-、A2-、H+、OH-;NaHA发生水解HA-+H2O H2A+OH-和电离HA-
H2A+OH-和电离HA- H++A2-,溶液中存在HA-、A2-、H+、OH-,所以两溶液中离子种类相同,A不正确。
H++A2-,溶液中存在HA-、A2-、H+、OH-,所以两溶液中离子种类相同,A不正确。
物质的量相等的Na2A和NaHA因为存在上述水解、电离等过程,阴离子数量发生变化,所以阴离子总量不相等,B不正确。
由电荷守恒可知c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-),C正确。Na2A溶液显碱性,c(OH-)>c(H+),D不正确。
答案: C
[例4] 化合物SOCl2是一种液态化合物,沸点77 ℃。在盛有10 mL水的锥形瓶中,小心地滴加8-10滴SOCl2,可观察到剧烈反应,液面上有白雾形成,并有带刺激性气味的气体逸出。该气体可使滴有品红试液的滤纸褪色。轻轻振荡锥形瓶,等白雾消失后,往溶液中滴加AgNO3溶液,有不溶于HNO3的白色凝乳状沉淀析出。
(1)根据上述实验,写出SOCl2和水反应的化学方程式:________________。
(2)AlCl3溶液蒸干灼烧得不到无水AlCl3,而用SOCl2与AlCl3·6H2O混合共热,可得到无水AlCl3,原因是________________。
解析:水解的本质是化合物中带正电的基团结合水中电离产生的OH-,而带负电部分结合水中电离产生的H+。据题给信息分析,产生的刺激性气体应是SO2,它是由SO2+结合OH-转化成H2SO3,而另一带负电的Cl-结合水电离的H+生成HCl,与AgNO3反应生成白色的AgCl沉淀。
答案: (1)SOCl2+H2O====SO2↑+2HCl
(2)因为蒸干AlCl3溶液时,由于AlCl3水解生成的HCl易挥发,而得到Al(OH)3,但当与SOCl2混合共热时,由于SOCl2极易吸水,防止了AlCl3的水解,有关的化学方程式为6SOCl2+AlCl3·6H2O====6SO2↑+AlCl3+12HCl
[例5]用酚酞、石蕊、0.1mol/L氨水、氯化铵晶体、0.1mol/L盐酸、熟石灰和蒸馏水,若仅用上述试剂怎样用简单实验方法证明氨水是弱碱?并指出是通过什么途径证明氨水是弱碱的?
解析:证明氨水是弱碱,可通过两条途径:一是证明氨水中存在电离平衡,如方案(1)。另一是证明NH4+作为弱碱阳离子能破坏水的电离平衡发生水解反应,如方案(2)、(3)。
答案: 方案(1)取少量氨水,滴加酚酞,溶液呈红色,然后向其中加人少量CH3COONH4晶体,振荡,可看到红色变浅,说明氨水中存在电离平衡,氨水为弱碱。
方案(2)取少量NH4Cl晶体溶于水,滴加石蕊试液,溶液显红色,说明NH4+水解生成了NH3·H2O和HCl,从而破坏了水的电离平衡,亦说明氨水是弱碱。
方案(3)将 0.1mol/L NH3· H2O与0.1mol/L盐酸等体积混合,再滴加石蕊试剂,溶液显红色,说明NH4+水解破坏了水的电离平衡,从而说明氨水是弱碱。
[变式]解释说明化学事实:向盛有少量Mg(OH)2 悬浊液培养皿中加入适量的饱和氯化铵溶液。现象
讨论解释其原因:同学甲:实验中存在Mg(OH)2的溶解、结晶平衡: Mg(OH)2(固) 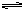 Mg2++2OH-。当加入NH4Cl时,由于NH4+水解,NH4++H2O
Mg2++2OH-。当加入NH4Cl时,由于NH4+水解,NH4++H2O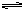 NH3·H2O+H+,使溶液呈酸性。H++OH-=H2O,从而使溶液中[OH-]减小,促进Mg(OH)2溶解,使溶液澄清。同学乙:实验中加入NH4Cl后,溶液中NH4+可与OH-结合从而使Mg(OH)2的溶解平衡右移使溶液澄清。甲、乙同学的两种解释谁的更有道理?
通过实验来进一步验证:
。为什么乙更合理?
NH3·H2O+H+,使溶液呈酸性。H++OH-=H2O,从而使溶液中[OH-]减小,促进Mg(OH)2溶解,使溶液澄清。同学乙:实验中加入NH4Cl后,溶液中NH4+可与OH-结合从而使Mg(OH)2的溶解平衡右移使溶液澄清。甲、乙同学的两种解释谁的更有道理?
通过实验来进一步验证:
。为什么乙更合理?
答案: Mg(OH)2溶解,使溶液澄清;乙同学的解释合理;向盛有少量Mg(OH)2悬浊液的培养皿中加入CH3COONH4 固体,观察悬浊液是否变澄清。CH3COONH4属弱酸弱碱盐,虽强烈水解但溶液呈中性。同时,CH3COONH4溶液中也有大量NH4+,若Mg(OH)2没有溶解,说明甲同学的解释正确。若Mg(OH)2溶解,则说明乙同学的解释正确;因为Mg(OH)2比 NH3· H2O的碱性强。
Ⅰ.判断溶液的酸碱性: ;
Ⅱ.判断不同弱电解质的相对强弱: ;
Ⅲ.比较溶液中离子浓度:
①同一溶液中不同离子浓度: 、
②不同溶液中相同离子浓度: 。
Ⅳ.解释某些化学现象及在生产生活中的应用: 。
。
⑴电荷守恒:电解质溶液中阴、阳离子所带的正、负电荷数相等,即溶液不显电性。如磷酸溶液中,c (H+)= c (OH-)+ c(H2PO4-)+2 c(HPO42-)+3 c(PO43-)
⑵物料守恒:就是电解质溶液中某一组分的原始浓度(起始浓度)应该等于它在溶液中各种存在形式的浓度之和。如0.1mol/L的NaHS溶液,0.1= c (HS-)+ c (S2-)+ c (H2S)或
c (Na+)= c (HS-)+ c (S2-)+ c (H2S)
⑶原理守恒:水电离的特征是c (H+)= c (OH-),据此可以得出下列关系如在K2CO3溶液中:c (OH-)= c (H+)+ c (HCO3-)+2(H2CO3)(也称质子守恒)
例题:分别以①H2S②NaHS③Na2S为例离子浓度的守恒关系:
⑴物料守恒① 、
② ③
⑵电荷守恒:① ②
③ ;
⑶质子守恒:① ②
③ 。
①多元弱酸溶液,根据多步电离分析,如在H3PO4的溶液中,c (H+)>c(H2PO4-)>c(HPO42-)>c(PO43-)
②多元弱酸的正盐溶液根据弱酸根的分步水解分析,如Na2CO3的溶液中,c (Na+)>c(CO32-)>c(OH-)>c(HCO3-)
③不同溶液中同一离子浓度的比较,要看溶液中其他离子对其影响的因素。如在相同的物质的量浓度的下列各溶液中a、NH4Cl b、CH3COONH4 c、NH4HSO4。c(NH4+)由大到小的顺序是 c>a>b。
④ 混合溶液中各离子浓度的比较,要进行综合分析,如电解因素、水解因素等。
分别以H2S、NaHS、Na2S为例:
①离子浓度的大小比较:H2S 、NaHS 、Na2S 。
①强酸弱碱盐的水解:溶液呈酸性,弱碱阳离子水解
②强碱弱酸盐的水解:溶液呈碱性,弱酸根离子水解
③弱酸弱碱盐的水解程度很大,溶液的酸碱性决定与酸碱性的相对强弱
Ⅰ.酸强于碱显酸性,如(NH4)2SO3
Ⅱ.碱强于酸显碱性,如NH4CN
Ⅲ.酸碱强弱相当的呈中性,如CH3COONH4
④强酸强碱盐,不水解,呈中性
⑤弱酸的酸式盐水解,酸取决于酸根离子的电离程度和水解程度的相对大小
Ⅰ如电离程度大于水解程度,以电离为主,溶液呈酸性,如NaHSO3、NaH2PO4
Ⅱ如水解程度大于电离程度,以水解为主,溶液呈碱性,如NaHCO3、Na2HPO4、NaHS
⑥完全双水解的盐,如Al3+与HCO3-、CO32-、S2-、AlO2-等发生双水解进行到底。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com