
2.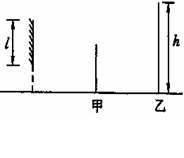 如图所示M是竖直放置的平面镜,平面镜离地面的距离
如图所示M是竖直放置的平面镜,平面镜离地面的距离
可调节。甲、乙二人站在镜前,乙离平面镜的距离为甲
离镜的距离的2倍,如图所示。二人略错开,以便甲能
看到乙的像。以l 表示镜的长度,h 表示乙的身高,为
使甲能看到镜中乙的全身像,l 的最小值为 ( )
A.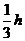 B.
B.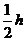 C.
C.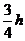 D.h
D.h
1.在教室课桌的正上方挂有一个发光的日光灯,晚上将一支钢笔平行日光灯放于课桌正上方,当钢笔距课桌较近时,可在课桌上看到比较清晰的钢笔影子,将钢笔逐渐向日光灯靠近,钢笔的影子逐渐模糊不清,这主要是由于 ( )
A.发生了明显的衍射现象, B.桌面后来未处于钢笔的影区,
C.桌面后来未处于钢笔的半影区, D.桌面后来未处于钢笔的本影区。
|
电解液 |
溶质类别 |
电解总反应式 |
相当于电解 |
溶液pH |
|
NaOH溶液 |
强碱 |
2H2O 2H2↑+O2↑ 2H2↑+O2↑ |
水 |
升高 |
 H2SO4溶液 H2SO4溶液 |
含氧酸 |
降低 |
||
|
Na2SO4溶液 |
活泼金属的含氧酸盐 |
不
变 (两极混合液) |
||
|
CuCl2溶液 |
不活泼金属的无氧酸盐 |
CuCl2 Cu+Cl2↑ Cu+Cl2↑ |
电解质本身 |
接近7 |
|
HCl溶液 |
无氧酸 |
2HCl H2↑+Cl2↑ H2↑+Cl2↑ |
升高 |
|
|
NaCl溶液 |
活泼金属的无氧酸盐 |
2NaCl+2H2O H2+2NaOH+Cl2↑ H2+2NaOH+Cl2↑ |
电解质与水 |
升高 |
|
CuSO4溶液 |
不活泼金属的含氧酸盐 |
2CuSO4+2H2O 2Cu+O2↑+2H2SO4 2Cu+O2↑+2H2SO4 |
降低 |
|
|
NaCl(熔融) |
离子化合物 |
2NaCl 2Na+Cl2↑ 2Na+Cl2↑ |
电解质本身 |
|
|
Al2O3(熔融) |
2Al2O3 4Al+3O2↑ 4Al+3O2↑ |
试题枚举
[例1] 镍氢电池是近年来开发出来的可充电电池,它可以取代会产生镉污染的镍镉电池。镍氢电池的总反应式是: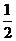 H2+NiO(OH)
H2+NiO(OH)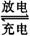 Ni(OH)2。根据此反应式判断,下列叙述中正确的是( )
Ni(OH)2。根据此反应式判断,下列叙述中正确的是( )
A.电池放电时,电池负极周围溶液的pH不断增大
B.电池放电时,镍元素被氧化
C.电池充电时,氢元素被还原
D.电池放电时,氢气是负极
 [解析] 本题考查在题目创设的新情景中运用所学电化学知识,解决具体问题的能力。首先是区别出充电运用的是电解原理,放电则是运用了原电池原理。抓住电解池、原电池各极发生氧化还原反应的特点,结合题给的信息进行分析判断:
[解析] 本题考查在题目创设的新情景中运用所学电化学知识,解决具体问题的能力。首先是区别出充电运用的是电解原理,放电则是运用了原电池原理。抓住电解池、原电池各极发生氧化还原反应的特点,结合题给的信息进行分析判断:
A:原电池负极反应式为: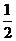 H2+OH-+e-
H2+OH-+e- Ni(OH)2,pH下降。故A不正确。
Ni(OH)2,pH下降。故A不正确。
B:原电池,NiO(OH)→Ni(OH)2,镍被还原。故B也不正确。同理可判断得:正确答案为CD。
[例2] 银器皿日久表面逐渐变黑色,这是由于生成硫化银,有人设计用原电池原理加以除去,其处理方法为:将一定浓度的食盐溶液放入一铝制容器中,再将变黑的银器浸入溶液中,放置一段时间后,黑色会褪去而银不会损失。试回答:在此原电池反应中,负极发生的反应为________;正极发生的反应为_________;反应过程中产生有臭鸡蛋气味的气体,则原电池总反应方程式为___________________________。
[解析] 要善于抓住题示信息,“黑色褪去而银不会损失”,必然发生变化:Ag2S Ag,显然这是原电池的正极反应,Ag2S+2e-
Ag,显然这是原电池的正极反应,Ag2S+2e-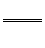 2Ag+S2-,负极反应为活泼金属发生氧化反应:Al-3e-
2Ag+S2-,负极反应为活泼金属发生氧化反应:Al-3e-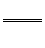 Al3+。正极生成的S2-和负极生成的Al3+在溶液中发生双水解:2Al3++3S2-+6H2O
Al3+。正极生成的S2-和负极生成的Al3+在溶液中发生双水解:2Al3++3S2-+6H2O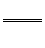 2Al(OH)3↓+3H2S↑,与题意产生臭鸡蛋气味的气体相吻合。原电池的总反应为上述三个反应的加合:3Ag2S+2Al+6H2O
2Al(OH)3↓+3H2S↑,与题意产生臭鸡蛋气味的气体相吻合。原电池的总反应为上述三个反应的加合:3Ag2S+2Al+6H2O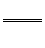 6Ag+2Al(OH)3↓+3H2S↑。
6Ag+2Al(OH)3↓+3H2S↑。
原电池:负极:M-ne-=Mn+
正极:(1)酸性溶液中2H++2e-=H2↑
(2)不活泼金属盐溶液Mn++ne-=M
(3)中性、弱酸性条件下2H2O+O2+4e-=4OH-
电解(镀)池:
阳极:(1)若阳极是由活性材料(除C、Pt、Au等以外的其它金属)做成,阳极反应是阳极金属失去电子而被氧化成阳离子;
(2)若阳极是由C、Pt、Au等惰性材料做成,阳极反应则是电解液中阴离子在阳极失去电子被氧化。阴离子失去电子能力大小顺序为:I->Br->Cl->OH->含氧酸根>F-。
阴极:阴极反应一般是溶液中的阳离子得电子的还原反应,阳离子得电子能力大小顺序为:Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+。必须注意的是,电镀时通过控制条件,Fe2+和Zn2+得电子的能力强于H+。
2.确定电解(镀)池电极名称的方法
方法一:与外电源正极连接的一极是阳极、与负极连接的一极是阴极。
方法二:电极上发生氧化反应的是阳极,发生还原反应的是阴极。
1.确定原电池电极名称的方法
方法一:根据电极材料的性质确定。通常是
(1)对于金属--金属电极,活泼金属是负极,不活泼金属是正极;
(2)对于金属--非金属电极,金属是负极,非金属是正极,如干电池等;
(3)对于金属--化合物电极,金属是负极,化合物是正极。
方法二:根据电极反应的本身确定。
失电子的反应→氧化反应→负极;得电子的反应→还原反应→正极。
6.在同一电解质溶液中,金属腐蚀的快慢可用下列原则判断:电解原理引起的腐蚀>原电池引起的腐蚀>化学腐蚀>有防护措施的腐蚀。
5.腐蚀的常见类型
(1)析氢腐蚀 在酸性条件下,正极发生2H++2e-=H2↑反应。
(2)吸氧腐蚀 在极弱酸或中性条件下,正极发生2H2O+O2+4e-=4OH-反应。
若负极金属不与电解质溶液发生直接的反应,则形成吸氧腐蚀的原电池反应。如生铁浸入食盐水中,会形成许多微小的原电池。
4.电化学腐蚀实质:不纯金属或合金在电解质溶液中发生原电池反应。电化学腐蚀过程有电流产生。
3.化学腐蚀实质:金属和非电解质或其它物质相接触直接发生氧化还原反应而引起的腐蚀。其腐蚀过程没有电流产生。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com