
6、晚清时期,有人提出:“议院者,公议政事之院也。集众思,广众益,用人行政,一秉至公,……”“昏暴之君无所施其虐,跋扈之臣无所擅其权,大小官司无所卸其职,草野小民无能积其怨,故断不至数代而亡,一朝而灭也。”依据上述观点,判断此人的主张是
A.废除君主制 B.建立总统制
C.实行君主立宪 D.倡导民主共和
5、中国首次出现的近代化方案中就主张建立社会保障制度:“一、兴跛盲聋哑院。有财者自携资斧,无财者善人乐助,请长教以鼓乐书数杂技,不致为废人也。一、兴鳏寡孤独院。准仁人济施,生则教以诗书各法,死则怜而葬之。……”这一方案应该是
A.魏源的《海国图志》 B.洪仁玕的《资政新篇》
C.梁启超的《变法通议》 D.孙中山颁布的《中华民国临时约法》
4、《清高宗实录》、“文景之治”、《永乐大典》三个专有名词中的“高宗”“文景”“永乐”分别是
A.谥号、年号、年号 B.庙号、谥号、年号
C.年号、尊号、庙号 D.尊号、谥号、庙号
3、五代以来君主七朝八姓,赵匡胤“黄袍加身”建立北宋后的百余年间,未发生类似的现象。一般认为,北宋政治体例的变革是重要原因,下列各项能全面反映其体例变革的一项是:
A.采用文官取代武将担任地方官 B.从中央到地方实行财政军分权
C.降低将官地位,疏远将兵关系 D.削弱相权另设枢密院管理军事
2、史载:汉景帝的弟弟梁孝王入宫晋见,景帝相当亲热,得知梁孝王有五位儿子,便赐给五人侯爵职位,并赏赐许多物品。梁孝王死后,景帝把梁孝王所遗之国分为五份,每位侯爵一份,又把他们提升为王。这段故事表明景帝的根本意图是
A.加深兄弟情谊 B.分割王国实力
C.加强中央集权 D.进一步推行分封制
1.钱穆认为“周部族融入,把中国文化规模摆出,大体确定,后来虽有不断的吸引融合,但我们已有了一个重心,以后都是内容的充实和边缘的扩充而已”。其中对“重心”的理解正确的是
A.宗法制 B.分封制 C.郡县制 D.行省制
44.



 (09年江苏化学·18)(10分)二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。与Cl2相比,ClO2不但具有更显著地杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
(09年江苏化学·18)(10分)二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。与Cl2相比,ClO2不但具有更显著地杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
 (1)在ClO2的制备方法中,有下列两种制备方法:
(1)在ClO2的制备方法中,有下列两种制备方法:
 方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
 方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O
 用方法二制备的ClO2更适合用于饮用水的消毒,其主要原因是
。
用方法二制备的ClO2更适合用于饮用水的消毒,其主要原因是
。
 (2)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2-).2001年我国卫生部规定,饮用水ClO2-的含量应不超过0.2 mg·L-1。
(2)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2-).2001年我国卫生部规定,饮用水ClO2-的含量应不超过0.2 mg·L-1。
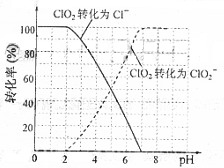
 饮用水中ClO2、ClO2-的含量可用连续碘量法进行测定。ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH的关系如右图所示。当pH≤2.0时,ClO2-也能被I-
饮用水中ClO2、ClO2-的含量可用连续碘量法进行测定。ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH的关系如右图所示。当pH≤2.0时,ClO2-也能被I-

 完全还原成Cl-。反应生成的I2用标准Na2S2O3溶液滴定:2Na2S2O3+I2=Na2S4O6+2NaI
完全还原成Cl-。反应生成的I2用标准Na2S2O3溶液滴定:2Na2S2O3+I2=Na2S4O6+2NaI
 ① 请写出pH≤2.0时,ClO2-与I-反应的离子方程式
。
① 请写出pH≤2.0时,ClO2-与I-反应的离子方程式
。
 ②请完成相应的实验步骤:
②请完成相应的实验步骤:
 步骤1:准确量取VmL水样加入到锥形瓶中。
步骤1:准确量取VmL水样加入到锥形瓶中。
 步骤2:调节水样的pH为7.0~8.0
步骤2:调节水样的pH为7.0~8.0
 步骤3:加入足量的KI晶体。
步骤3:加入足量的KI晶体。
 步骤4:加少量淀粉溶液,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1mL。
步骤4:加少量淀粉溶液,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1mL。
 步骤5: 。
步骤5: 。
 步骤6;再用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。
步骤6;再用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。
 ③根据上述分析数据,测得该引用水样中的ClO2-的浓度为 mg·L-1(用含字母的代数式表示)。
③根据上述分析数据,测得该引用水样中的ClO2-的浓度为 mg·L-1(用含字母的代数式表示)。
 ④若饮用水中ClO2-的含量超标,可向其中加入适量的,该反应的氧化产物是 (填化学式)
④若饮用水中ClO2-的含量超标,可向其中加入适量的,该反应的氧化产物是 (填化学式)
 答案:
答案:
(1)方法二制备的ClO2中不含Cl2
 (2)①ClO2-+4H++4I-=Cl-+2I2+2H2O
(2)①ClO2-+4H++4I-=Cl-+2I2+2H2O
 ②调节溶液的pH≤2.0
②调节溶液的pH≤2.0
 ③
③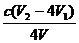
 ④Fe(OH)3
④Fe(OH)3

 解析:(1)比较简单,观察两组方程式,看看产物结合其性质即能得出答案。(2)pH≤2.0时,ClO2-也能被I-
解析:(1)比较简单,观察两组方程式,看看产物结合其性质即能得出答案。(2)pH≤2.0时,ClO2-也能被I- 完全还原成Cl-,那么I-要被氧化为碘单质,溶液是酸性溶液即可正确写出离子方程式。题目信息提示用的是连续碘量法进行测定,步骤6又用Na2S2O3溶液滴定至终点,说明步骤5中有碘生成,结合① 请写出pH≤2.0时,ClO2-与I-反应的离子方程式与pH为7.0~8.0的溶液中存在ClO-可以判断调节溶液的pH≤2.0
完全还原成Cl-,那么I-要被氧化为碘单质,溶液是酸性溶液即可正确写出离子方程式。题目信息提示用的是连续碘量法进行测定,步骤6又用Na2S2O3溶液滴定至终点,说明步骤5中有碘生成,结合① 请写出pH≤2.0时,ClO2-与I-反应的离子方程式与pH为7.0~8.0的溶液中存在ClO-可以判断调节溶液的pH≤2.0 。求引用水样中的ClO2-的浓度可以用关系式法以碘单质为桥梁正确的找准ClO2-与Na2S2O3的关系。Fe2+将ClO2-还原成Cl-,Fe2+被氧化为铁离子,结合反应物不难得出答案
。求引用水样中的ClO2-的浓度可以用关系式法以碘单质为桥梁正确的找准ClO2-与Na2S2O3的关系。Fe2+将ClO2-还原成Cl-,Fe2+被氧化为铁离子,结合反应物不难得出答案

 [考点分析]关注题目给与的信息从题目中挖掘有用的信息,注意关键词如本题的连续碘量法。
[考点分析]关注题目给与的信息从题目中挖掘有用的信息,注意关键词如本题的连续碘量法。
45 .(09年天津理综·9)(18分)海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列。从海水中提取食盐和溴的过程如下:
.(09年天津理综·9)(18分)海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列。从海水中提取食盐和溴的过程如下:

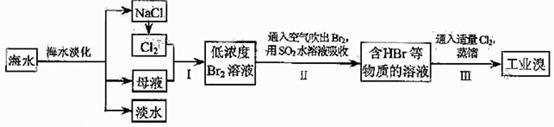
 (1)请列举海水淡化的两种方法: 、 。
(1)请列举海水淡化的两种方法: 、 。
 (2)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、 、 、或H2、 。
(2)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、 、 、或H2、 。
 (3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br,其目的为
。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br,其目的为
。
 (4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为 ,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是
。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为 ,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是
。
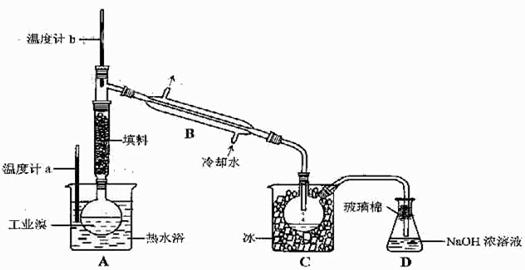
 (5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,了如下装置简图:
(5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,了如下装置简图:

 请你参与分析讨论:
请你参与分析讨论:
 ①图中仪器B的名称:
。
①图中仪器B的名称:
。
 ②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是
。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是
。
 ③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:
。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:
。
 ④C中液体产生颜色为 。为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是
。
④C中液体产生颜色为 。为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是
。
答案:(1)蒸馏法、电渗析法、离子交换法及其其他合理答案中的任意两种
(2)Cl2 NaOH NaClO
(3)富集溴元素
(4)Br2+SO2+2H2O=4H++SO42-+2Br- 强酸对设备的严重腐蚀
(5)①冷凝管 ②Br2腐蚀橡胶③控制温度计b的温度,并收集59℃的馏分④深红棕色 分液(或蒸馏)
解析:本题考查海水中提取溴的实验。电解NaCl溶液的方程式为:2NaCl
+ 2H2O  2NaOH+H2↑+Cl2↑,其中Cl2有可能与NaOH会生成NaClO。步骤I中的Br2的浓度很小,多次用SO2反复吸收,最终用Cl2处理,则可获得大量的工业溴。溴具有强氧化性可以氧化SO2,生成H2SO4,因此要注意酸对设备的腐蚀问题。溴具有腐蚀性,可以腐蚀橡胶。蒸馏的目的,就是通过沸点不同而提纯Br2,所以要通过温度计控制好Br2沸腾的温度,尽可能使Br2纯净。
2NaOH+H2↑+Cl2↑,其中Cl2有可能与NaOH会生成NaClO。步骤I中的Br2的浓度很小,多次用SO2反复吸收,最终用Cl2处理,则可获得大量的工业溴。溴具有强氧化性可以氧化SO2,生成H2SO4,因此要注意酸对设备的腐蚀问题。溴具有腐蚀性,可以腐蚀橡胶。蒸馏的目的,就是通过沸点不同而提纯Br2,所以要通过温度计控制好Br2沸腾的温度,尽可能使Br2纯净。
43. (09年海南化学·20.4)(11分)
(09年海南化学·20.4)(11分)
 工业上常用氨氧化法生产硝酸,其过程包括氨的催化氧化(催化剂为铂铑合金丝网)、一氧化氮的氧化和水吸收二氧化氮生成硝酸。请回答下列问题:
工业上常用氨氧化法生产硝酸,其过程包括氨的催化氧化(催化剂为铂铑合金丝网)、一氧化氮的氧化和水吸收二氧化氮生成硝酸。请回答下列问题:
 (1)氨催化氧化的化学方程式为
:
(1)氨催化氧化的化学方程式为
:
 (2)原料气中空气必须过量,其主要原因是
;
(2)原料气中空气必须过量,其主要原因是
;
 (3)将铂铑合金做成薄丝网的主要原因是
;
(3)将铂铑合金做成薄丝网的主要原因是
;
 (4)水吸收二氧化氮生成硝酸为放热反应,其化学方程式为
,为了提高水对二氧化氮的吸收率,可采取的措施为
(答2项)。
(4)水吸收二氧化氮生成硝酸为放热反应,其化学方程式为
,为了提高水对二氧化氮的吸收率,可采取的措施为
(答2项)。
答案:(11分)
(1)4NH3+5O2 4NO+6H2O
4NO+6H2O (3分)
(3分)
 (2)提高氨的转化率和一氧化氮的转化率(2分)
(2)提高氨的转化率和一氧化氮的转化率(2分)
 (3)增大单位质量的催化剂与反应物的接触面积(2分)
(3)增大单位质量的催化剂与反应物的接触面积(2分)
 (4)3NO2+H2O=2HNO3+NO 加压 降温(4分)
(4)3NO2+H2O=2HNO3+NO 加压 降温(4分)
解析:(1)
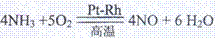
(2)根据平衡原理,增大反应物的浓度,平衡向正反应方向移动,以提高原料的转化率;
(3)这是为了增大铂铑合金的表面积,使接触面积增大,提升催化的效果;
(4)为了提高吸收率,可根据溶解过程放热采用降温处理,且气体的吸收可用加压的方式。
42. (09年海南化学·16)(9分)
(09年海南化学·16)(9分)
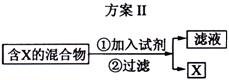
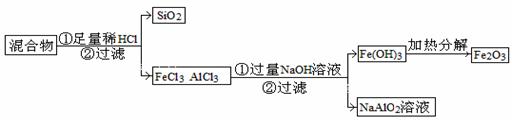
 下图表示从固体混合物中分离X的2种方案,请回答有关问题。
下图表示从固体混合物中分离X的2种方案,请回答有关问题。

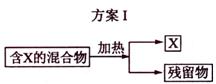
 (1)选用方案I时,X应该具有的性质是
,残留物应该具有的性质是
;
(1)选用方案I时,X应该具有的性质是
,残留物应该具有的性质是
;
 (2)选用方案Ⅱ从某金属粉末(含有Au、Ag和Cu)中分离Au,加入的试剂是 ,有关反应的化学方程式为
;
(2)选用方案Ⅱ从某金属粉末(含有Au、Ag和Cu)中分离Au,加入的试剂是 ,有关反应的化学方程式为
;
 (3)为提纯某Fe2O3样品(主要杂质有SiO2、A12O3),参照方案I和Ⅱ,请设计一种以框图形式表示的实验方案(注明物质和操作)
。
(3)为提纯某Fe2O3样品(主要杂质有SiO2、A12O3),参照方案I和Ⅱ,请设计一种以框图形式表示的实验方案(注明物质和操作)
。
答案:(9分)
 (1)有挥发性(或易升华)
受热不挥发,且具有较高的热稳定性(2分)
(1)有挥发性(或易升华)
受热不挥发,且具有较高的热稳定性(2分)
 (2)HNO3 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(2)HNO3 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
3Ag+4HNO3(稀)=3AgNO3+NO↑+2H2O
[或Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
Ag+2HNO3(浓)=AgNO3+NO2↑+2H2O]

 (3分)
(3分)
 (3)
(3)
 (4分)(其他合理答案:也可给分)
(4分)(其他合理答案:也可给分)
解析:(1)从题中给的信息可理解为升华或蒸馏,因此X的性质为加热时可升华,或易挥发。残留物必须热稳定性好,且没有挥发性。
(2)金、银、铜三种金属金的活泼性最差,不能与硝酸反应,选用硝酸作为试剂,过滤即可。
(3)三种氧化物中,SiO2、Al2O3都能与强碱发生反应,但Fe2O3不会反应,可以选浓NaOH溶液反应后过滤。但如果SiO2的含量大,则不宜用前面所述方法,可选用盐酸溶解,过滤后去除SiO2,再在混合液中加入过量的溶液,过滤得Fe(OH)3沉淀,洗涤后加热分解的方法。
41. (09年海南化学·13)(9分)
(09年海南化学·13)(9分)
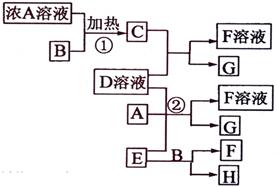
 有关物质存在如图所示的转化关系(部分产物已省略)。通常C为气体单质,G为紫黑色固体单质。实验室中,常用固体E在B的催化下加热制取气体单质H。
有关物质存在如图所示的转化关系(部分产物已省略)。通常C为气体单质,G为紫黑色固体单质。实验室中,常用固体E在B的催化下加热制取气体单质H。


 请回答下列问题:
请回答下列问题:
 (1)反应①的化学方程式为
(1)反应①的化学方程式为
 (2)反应②的离子方程式为
(2)反应②的离子方程式为
 (3)写出另外一种实验室制取H的化学方程式
(3)写出另外一种实验室制取H的化学方程式
 (4)D溶液与Pb(NO3)2溶液混合可形成沉淀,此沉淀的Ksp=7.0×10-9。将等体积的D溶液与Pb(NO3)2溶液混合,若D的浓度为1×10-2mo1/L
,则生成沉淀所需Pb(NO3)2溶液的最小浓度为
。
(4)D溶液与Pb(NO3)2溶液混合可形成沉淀,此沉淀的Ksp=7.0×10-9。将等体积的D溶液与Pb(NO3)2溶液混合,若D的浓度为1×10-2mo1/L
,则生成沉淀所需Pb(NO3)2溶液的最小浓度为
。
答案:(9分)


 (1)MnO2+4HCl(浓)
(1)MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O(2分)
MnCl2+Cl2↑+2H2O(2分)
 (2)6I-+ClO3-+6H+=3I2+Cl-+3H2O(2分)
(2)6I-+ClO3-+6H+=3I2+Cl-+3H2O(2分)
 (3)2H2O2
(3)2H2O2 2H2O+O2↑或2KMnO4
2H2O+O2↑或2KMnO4 K2MnO4+MnO2+O2↑(其他合理答案:也给分)(2分)
K2MnO4+MnO2+O2↑(其他合理答案:也给分)(2分)
 (4)5.6×10-4mol·L-1(3分)
(4)5.6×10-4mol·L-1(3分)
解析:首先得破框图,G为紫黑色固体单质,一般可预测为碘单质,可推得C物质为氯气,则A为盐酸、B为二氧化锰;E在二氧化锰的催化下制取H,则E为氯酸钾、H为氧气;F为氯化钾;于是D一定为碘化钾。所以推出A盐酸、B二氧化锰、C氯气、D碘化钾、E氯酸钾、F氯化钾、G碘、H氧气。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com