
31.工业上用氨气与空气的混合气在一定条件下制硝酸,发生的反应是:
① 4NH3+5O2 →4NO+6H2O ② 4NO+3O2+2H2O→4HNO3
设空气中氧气的体积分数为0.20,氮气体积分数为0.80,请完成下列填空及计算:
(1)为使氨气恰好完全氧化为一氧化氮,氨气与空气的混合气中氨的体积分数(用小数表示)为________(保留2位小数)。
(2)现将1 mol的氨气与12 mol的空气混合反应,可得到硝酸 mol;
(3)向上述溶液中加入 mL 20%的硝酸(密度为1.11g/mL),才能得到69%的硝酸溶液。
(4)现有100mol的原料气,其中含氨气为xmol,反应后生成的硝酸ymol。在得到硝酸的条件下,写出x与y的关系式。(写出解题过程)
30.(6分)过氧化钙是一种安全无毒的物质,带有数量不等的结晶水,通常还含有部分CaO。
( 1)称取24.4g过氧化钙样品,灼热时发生如下反应:
1)称取24.4g过氧化钙样品,灼热时发生如下反应:
 2CaO2·xH2O? 2CaO+O2↑+2xH2O,得到的O2在标准状况下体积为2.24L。该样品中CaO2的物质的量为
。
2CaO2·xH2O? 2CaO+O2↑+2xH2O,得到的O2在标准状况下体积为2.24L。该样品中CaO2的物质的量为
。
(2)另取同一样品24.4g,溶于适量的稀盐酸中,然后加入足量的Na2CO3溶液,将溶液中Ca2+全部转化为CaCO3沉淀,得到干燥的CaCO3 25g。
试计算:
①样品中CaO的质量: 。
②样品中CaO2·xH2O的x值: 。
29.国家食品监督局发出公告“警惕油炸食品中的丙烯酰胺(CH2 = CH-CONH2)”,丙烯酰胺对人体可造成神经毒性和遗传毒性。下图流程中的有机物K是丙烯酰胺的相邻同系物。
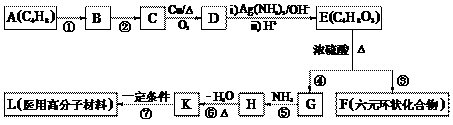
请回答下列问题:
(1)① ~ ⑦反应中属于加成反应的有 ___________,属于消除反应的是 ___________。
(2)写出反应条件 ② _____________________。
(3)写出结构简式 B ______________________,H ______________________。
(4)写出下列反应的化学方程式:
C→D _____________________________________________________________
E→F ______________________________________________________________
(5)反应③除生成F、G外,还可能生成其它副产物,任写其中两种不同类别产物的结构简式_______________________________________、______________________。
28.A是石油化工的一种裂解气,用途广泛,下图是以石油为原料的一系列反应。

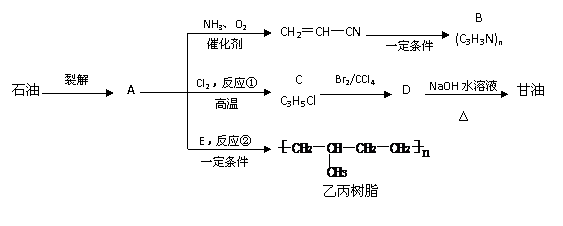

 (1)写出反应类型:反应①
,反应②
。
(1)写出反应类型:反应①
,反应②
。
 (2)写出结构简式:B
,E
。
(2)写出结构简式:B
,E
。
 (3)写出C→D的化学方程式:
。
(3)写出C→D的化学方程式:
。
 (4)甘油与乙酸反应后产物可能有 种(水除外),其中相对分子质量最大的结构简式:
。
(4)甘油与乙酸反应后产物可能有 种(水除外),其中相对分子质量最大的结构简式:
。 .
.
27.(12分)某化学实验小组的同学为了探究和比较SO2和Cl2水的漂白性,设计了如下的实验装置。
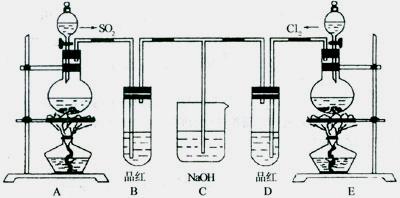
(1)实验室用装置A制备SO2气体,写出A中发生反应的化学方程式: 。
(2)①反应开始后一段时间后,观察到B、D两个试管中的品红溶液出现的现象是: :(填写序号字母)
I.都褪色 II.都不褪色 Ⅲ.B褪色,D不褪色 Ⅳ.B不褪色,D褪色
②停止通气后,再给B、D两个试管加热,两个试管中的现象分别为
B: ,D: 。
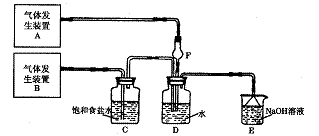 (3)第二个实验小组的同学认为SO2和Cl2水都有漂白性,若二者混合后的漂白性会更强,他们设计了下图装置,并将制得的SO2和Cl2同时通入到加有品红溶液的D中,探究SO2和Cl2混合通入的漂白效果。实验发现:
(3)第二个实验小组的同学认为SO2和Cl2水都有漂白性,若二者混合后的漂白性会更强,他们设计了下图装置,并将制得的SO2和Cl2同时通入到加有品红溶液的D中,探究SO2和Cl2混合通入的漂白效果。实验发现:
①若两种气体1:1比例通入,D中品红不褪色,原因是(方程式表示) ________________;
其中气体发生装置B制备的气体为_____________,F装置的球型管和D装置的倒置漏斗共同具有的作用是_________________________。
 ②若两种气体不按1:1比例通入,为验证通入D装置中气体是Cl2还是SO2过量,兴趣小组的同学准备了以下试剂:
②若两种气体不按1:1比例通入,为验证通入D装置中气体是Cl2还是SO2过量,兴趣小组的同学准备了以下试剂:
a 氯化铁溶液 b 氯化亚铁溶液 c 硫氰化钾溶液 d苯酚溶液 e 品红溶液 f 酸性高锰酸钾溶液
d苯酚溶液 e 品红溶液 f 酸性高锰酸钾溶液  。若Cl2过量:取适量D中溶液滴加至盛有
(选填一个序号)试剂的试管内,再加入 _______(选填一个序号)试剂,发生的现象是:
_
。若Cl2过量:取适量D中溶液滴加至盛有
(选填一个序号)试剂的试管内,再加入 _______(选填一个序号)试剂,发生的现象是:
_
26. (12分) 为探讨“乙醇催化氧化实验”,某教师设计了如图装置(夹持装置仪器已省略),其实验操作为:先按图安装好,先关闭活塞a、b、c,在铜丝的中间部分加热片刻,然后打开活塞a、b、c,通过控制活塞a和b,而有节奏(间歇性)通入气体,即可在M处观察到明显的实验现象。
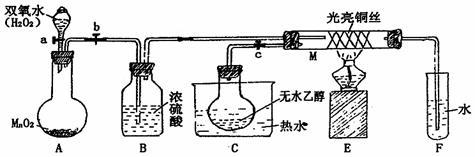
(1)A中发生反应的化学方程式:_______________________________ ,B的作用:_________________________;C中热水的作用:______________________。
(2)M处发生的反应的化学方程式为:_______________________________
(3)从M管中可观察到的现象:_______________________________,实验中移走酒精灯,实验现象仍可保持,说明M处的反应为 ________热反应(填吸热或放热)。
(4)实验结束后,可用 试剂检验乙醇氧化后的产物,请写出检验反应对应的化学方程式 。
(5)若试管F中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有 。要除去该物质,可现在混合液中加入 (填写字母)。
A.氯化钠溶液 B.苯 C.碳酸氢钠溶 D.四氯化碳
25.现有可逆反应:m A (g)
+ n B (g)  p C
(g),达到平衡后,当升高温度时,B的体积分数变变小;当减小压强时,混合体系中C的质量分数也减小,则:
p C
(g),达到平衡后,当升高温度时,B的体积分数变变小;当减小压强时,混合体系中C的质量分数也减小,则:
 ⑴ 该反应的逆反应为 热反应,且m + n p (填“>”、“=”、“<”)。
⑴ 该反应的逆反应为 热反应,且m + n p (填“>”、“=”、“<”)。
 ⑵ 减压时,A的质量分数
(填“增大”、“减小”、“不变”,下同)正反应速率
⑵ 减压时,A的质量分数
(填“增大”、“减小”、“不变”,下同)正反应速率
 ⑶ 若加入B (体积不变),则A的转化率
⑶ 若加入B (体积不变),则A的转化率
 ⑷
⑷  若加入催化剂,平衡时气体混合物的总物质的量
(填变大、变小或不变)
若加入催化剂,平衡时气体混合物的总物质的量
(填变大、变小或不变)
 (5)若B是有色物质,A、C均无色,则加入C (体积不变) 时混合物颜色
;而
(5)若B是有色物质,A、C均无色,则加入C (体积不变) 时混合物颜色
;而
 维持容器内压强不变,充入氖气时,混合物颜色
(填“变深”、“变浅”或“不变”
维持容器内压强不变,充入氖气时,混合物颜色
(填“变深”、“变浅”或“不变”
24. 近年来,储氢纳米碳管研究获重大进展。电弧法合成的碳纳米管,常伴有大量杂质--纳米颗粒。这种碳纳米颗粒可借氧化气法提纯。其反应式是:
3 C+ 2 K2Cr2O7+ 8 H2SO4→ 8 H2O + 2 K2SO4 + 2 Cr2(SO4)3+ 3 CO2
(1)标出电子转移的数目和方向。
(2)此反应的氧化剂是 ,氧化产物是 。
(3)H2SO4在上述反应中表现出来的性质是 (填选项编号)
A、酸性 B氧化性 C吸水性 D脱水性
(4)上述反应中若产生0.1mol气体物质,则转移电子的物质的量是 mol。
23.下表是元素周期律的一部分。据表中的10种元素,用元素符号或化学式、化学用语填空。
|
族
周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
2 |
① |
|
|
⑤ |
⑦ |
|
|
|
|
3 |
② |
③ |
④ |
⑥ |
⑧ |
⑨ |
⑩ |
|
(1)、在写出元素⑦的气态氢化物的电子式 ; (2)、写出元素②与④的最高价氧化物对应水化物之间反应的离子方程式 ; (3)、元素②、③、④的最高价氧化物对应的水化物中碱性最强的是 ; (4)、 将元素②、③、④、⑨ 、⑩形成的简单离子半径按照由大到小顺序排列 ; (5)、元素⑨ 与⑩比较,非金属性强的是 ;下列表述中能证明这一事实的是
a. 常温下的⑩单质和⑨的单质状态不同
b . ⑩的氢化物比⑨的氢化物稳定
c. 一定条件下⑩和⑨的单质都能与氢氧化钠溶液反应
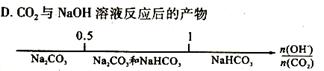
22.研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到的直观形象的效果。下列表达正确的是
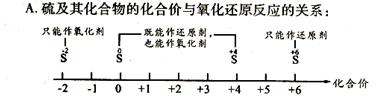
B.Fe在Cl2中的燃烧产物: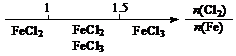
C.AlCl3溶液中滴加NaOH后铝的存在形式: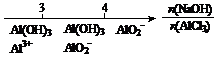
第Ⅱ卷(非选择题 共84分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com