
2、氧化铜与氢气的反应
1、铜和氧气的反应
1、制印刷电路时,常用氯化铁溶液作为“腐蚀液”,发生的反应为2FeCl3 +Cu == 2FeCl2 +CuCl2 ,向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是( )
A、烧杯中有铜无铁 B、烧杯中有铁无铜
C、烧杯中铁铜都有 D、烧杯中铁铜都无
1、铁的氧化物
[投影总结]铁的氧化物的性质比较。
|
|
FeO |
Fe2O3 |
Fe3O4 |
|
俗名 |
|
铁红 |
磁性氧化铁 |
|
色态 |
黑色粉末 |
红棕色粉末 |
黑色晶体 |
|
价态 |
+2价 |
+3价 |
+3,+2价 |
|
水溶性 |
不溶 |
不溶 |
不溶 |
|
稳定性 |
不稳定,在空气里加热迅速被氧化 |
稳定 |
稳定 |
|
非氧化性反应 |
碱性氧化物FeO+2H+==Fe2++H2O |
碱性氧化物 Fe2O3 + 6H+ == 2Fe3+ + 3H2O |
复杂氧化物,Fe3O4
+8H+ ==
Fe2+ + 2Fe3+ +4H2O |
|
与氧化性酸反应 |
3FeO + 10HNO3 ==3Fe(NO3)3
+ NO↑ + 5H2O |
Fe2O3 + 6H+ == 2Fe3+ + 3H2O |
3 Fe3O4 +
28 HNO3 == 9Fe(NO3)3
+NO↑+14 H2O |
|
共性 |
高温时,都能被C、CO、H2、Al等还原剂还原,还原过程中Fe的价态降低,最终生成Fe |
[板书]2、铁的氢氧化物
氢氧化铁( iron(Ⅲ) hydroxide)
氢氧化亚铁( iron(Ⅱ) hydroxide)
[实验3-9]Fe(OH)2和Fe(OH)3的制备
实验步骤:在2支试管晨分别加入少量FeCl3和FeSO4 溶液,然后滴入NaOH溶液,观察并描述发生的现象。
|
|
FeCl3 溶液 |
FeSO4 溶液 |
|
加 NaOH 溶液 |
立即产生红褐色沉淀 |
开始时生成白色絮状沉淀,迅速变成灰绿色,最后变成红褐色 |
|
离子 方程式 |
Fe3++3OH―==Fe(OH)3↓ |
Fe2++2OH―==Fe(OH)2 ↓ 4Fe(OH)2 + O2 + 2H2O == 4Fe(OH)3 |
[讲]生成Fe(OH)2 时,开始生成白色絮状沉淀是Fe(OH)2,最后生成的红褐色沉淀是Fe(OH)3,从Fe的化合价来看,Fe(OH)2 被什么氧化了?
(被空气中O2氧化)
[讲]由此可知,Fe(OH)2 极易被氧化,所以在配制反应时要用沸水,尽量降低O2的溶解度。
[思考1]实验中为什么要用新制的Fe SO4 溶液?
(Fe SO4 易被空气中O2氧化)
[思考2]怎样才能使Fe2+ 溶液能能长时间保存呢?
(在配制溶液时,要加少量Fe 防止氧化,加少量酸抑制其水解)
[思考3]实验中为什么要将滴管尖端插入试管底部,且慢慢挤出NaOH溶液?
(Fe(OH)2 极易被氧化,预防带入空气)
[讲]Fe(OH)2、Fe(OH)3均为弱碱,具有碱的通性。
[投影]Fe(OH)2和Fe(OH)3的性质比较
|
|
Fe(OH)2 |
Fe(OH)3 |
|
色态 |
白色固体 |
红褐色固体 |
|
溶解性 |
难溶于水 |
难溶于水 |
|
类别 |
二元弱碱 |
三元弱碱 |
|
与非氧化性酸 |
Fe(OH)2
+2H+ == Fe2++2H2O |
Fe(OH)3
+3H+ == Fe3++3H2O |
|
与氧化性酸 |
3Fe(OH)2+10HNO3 == 3Fe(NO3)3 +NO↑+8H2O |
Fe(OH)3
+3H+ == Fe3++3H2O |
|
稳定性 |
分解产生很复杂 |
2Fe(OH)3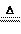 Fe2O3+3H2O Fe2O3+3H2O
|
|
制法 |
Fe2++2OH―==Fe(OH)2 ↓ |
Fe3++3OH―==Fe(OH)3 ↓ |
|
转化关系 |
4Fe(OH)2+O2+2H2O== 4Fe(OH)3 |
[板书]3、铁盐和亚铁盐
(1) 常见的亚铁盐(绿色): FeCl2 、FeSO4
具有强还原性,必须现制现用
保存方法:加入少量铁粉
常见的铁盐(黄色):FeCl3、Fe2(SO4)3
具有强氧化性
[实验3-10]Fe3+的检验
实验步骤:在2支试管里分别加入5 mL FeCl2 溶液和5 mL FeCl3溶液,各滴入几滴KSCN溶液。观察现象并记录
|
|
滴入KSCN溶液 |
|
FeCl3溶液 |
呈血红色 |
|
FeCl2溶液 |
无变化 |
[板书](2)Fe3+ 的检验
Fe3++3SCN-==Fe(SCN)3 (血红色)
[讲]我们利用这一特别现象来检验Fe3+,险些之外,还可用与NaOH溶液反应。
[板书]Fe2++2OH―==Fe(OH)2 (白色絮状沉淀)
4Fe(OH)2↓+O2+2H2O==4Fe(OH)3↓
白色――灰绿色――红褐色
Fe3++3OH― ==Fe(OH)3 ↓(红褐色沉淀)
[科学探究]Fe3+ 的氧化性
实验步骤:在盛有2 mL FeCl3 溶液的试管中,加入少量铁粉,振荡试管,充分反应后,滴入几滴KSCN溶液,观察并记录现象。再加入几滴氯水,又发生了什么变化?
|
FeCl3溶液中加入 |
现象 |
反应的离子方程式 |
|
铁粉,KSCN溶液 |
不显血红色 |
2Fe3++Fe==3Fe2+ |
|
氯水,振荡 |
显血红色 |
2Fe2+ +Cl2==2Fe3++2Cl― |
[板书](3) Fe3+的氧化性
[讲]Fe3+遇到较强的还原剂时,会被还原成Fe2+ ;而Fe2+ 在较强的氧化剂的作用下会被氧化成Fe3+
[板书]亚铁盐和铁盐之间可以相互转化
[小结]Fe3+和Fe2+结构不同,所带电荷不同,性质差异就很大,通过这节课的学习,我们应该知道结构相似,性质必然相似;结构不同,性质必然不同。
[自我评价]
2、某物质灼烧时,焰色反应为黄色,下列判断正确的是( )
A、该物质一定是钠的化合物
B、该物质一定含钠元素
C、该物质一定是金属钠
D、不能确定该物质中是否含有钾元素
教 案
|
课题:第三章 第二节 几种重要的金属化合物(二) |
授课班级 |
|
|||||||||||||||||||||
|
课 时 |
|
||||||||||||||||||||||
|
教 学 目 的 |
知识 与 技能 |
1、以Al2O3 、Al(OH)3 为代表,了解两性物质的特点。以KAl(SO4)2 为代表,使学生掌握复盐的组成特点。 |
|||||||||||||||||||||
|
过程 与 方法 |
1、通过列表比较,了解各类金属化合物的性质,同时掌握学习元素化合物的方法------比较法。 2、通过对几个实验的探究,体会实验方法在化学研究中的作用,并认识到实验过程中控制实验条件的重要性。 |
||||||||||||||||||||||
|
情感 态度 价值观 |
1、通过实验、图表分析、联系生活等多渠道的科学探究,发展学习化学的兴趣,乐于探究物质变化的奥秘 |
||||||||||||||||||||||
|
重 点 |
氢氧化铝的性质 |
||||||||||||||||||||||
|
难 点 |
两性氢氧化物概念的形成。 |
||||||||||||||||||||||
|
知 识 结 构 与 板 书 设 计 |
二、铝的重要化合物 1、氧化铝( aluninum oxide) Al2O3是典型的两性氧化物(amphoteric oxide) Al2O3+6H+==2Al3++3H2O Al2O3+6OH―==2AlO2―+H2O 2、氢氧化铝(aluninum hydroxide) Al(OH)3是典型的两性氢氧化物(amphoteric hydroxide) (1)化学性质: Al(OH)3+3H+==Al3++3H2O Al(OH)3+OH―==AlO2―+2H2O H++AlO2―+H2O  Al(OH)3 Al(OH)3 Al3++3OH― Al3++3OH― 酸式电离 碱式电离 (2)Al(OH)3 的制备 [投影实验3-7]Al(OH)3 的制备 Al3++3NH3 ·H2O == Al(OH)3 ↓+ 3NH4+ Al2(SO4)3+6NH3 ·H2O ==2Al(OH)3↓+3 (NH4)2SO4 2Al(OH)3  Al2O3+3H2O Al2O3+3H2O
3、硫酸铝钾 KAl(SO4)2 复盐:KAl(SO4)2==K++Al3++2SO42― Al3++3H2O  Al(OH)3+3H+ Al(OH)3+3H+ |
||||||||||||||||||||||
|
教学过程 |
|||||||||||||||||||||||
|
教学步骤、内容 |
教学方法、手段、师生活动 |
||||||||||||||||||||||
|
[引入]19世纪,法国王宫一次宴会上,法国皇帝拿破仑三世独自用一种比金、银轻得多的金属制成的刀叉,而其他人都用黄金或白银制的餐具,以体现其王者的风范。大家猜猜看,拿破仑的刀叉是用什么金属制成的? 这种金属就是铝,由于当时冶炼铝很难,铝十分珍贵,据说泰国当时的国王曾用过铝制的表链;1855年巴黎万国博览会上,展出了一小块铝,标签上写到:“来自黏土的白银”,并将它放在最珍贵的珠宝旁边;直到1889年,伦敦化学会还把铝合金制的花瓶和杯子作为贵重的礼物送给门捷列夫。 随着科学技术的发展,铝的冶炼变得很简单,现在铝和铝制品在生活中,可以说无处不在。 [问]Al是较活泼的金属,那么,它们都以何种形态存在自然界中? (在自然界中仅有化合态) [板书]二、铝的重要化合物 [讲]Al占地壳总质量的7.7%,在所有元素中是第3位,在金属中为第1位,主要存在的形式为:铝土矿(Al2O3)、明矾石、长石、云母等。 [过]Al的最常见的重要化合物有Al2O3、Al(OH)3、KAl(SO4)2等,它们有哪些性质呢?下面我们就来学习这几种重要的Al的化合物的性质。 [板书]1、氧化铝( aluninum oxide) [讲]Al2O3为白色粉末,不溶于,熔点2050℃,用作耐火材料,自然界中纯净的Al2O3为无色晶体,俗称刚玉。硬度仅次于金刚石,通常所说的是红蓝宝石是混有少量不同氧化物杂质的刚玉。我们曾介绍过Al2O3是典型的两性氧化物。 [板书]Al2O3是典型的两性氧化物(amphoteric oxide) Al2O3+6H+==2Al3++3H2O Al2O3+6OH―==2AlO2―+H2O [讲]Al2O3呈两性,那么它对应的水化物――Al(OH)3的性质又怎么样呢? [板书]2、氢氧化铝(aluninum hydroxide) [讲]我们曾提到过Al(OH)3 是典型的两性氢氧化物,既能跟酸起反应,又能跟碱起反应。 [板书] Al(OH)3是典型的两性氢氧化物(amphoteric hydroxide) [讲]实验表明,Al(OH)3在HCl和NaOH溶液里都能溶解,这就说明它既能跟酸起反应,又能跟碱起反应。 [板书](1)化学性质: Al(OH)3+3H+==Al3++3H2O Al(OH)3+OH―==AlO2―+2H2O [思考]Al(OH)3能与所有碱液发生反应呢? (不能,只能强碱溶液起反应) [问]为什么Al(OH)3具有两性呢? (根据其性质推测,Al(OH)3既可电离出H+,也可电离也OH―) [讲]Al(OH)3 在水溶液中有两种电离方式。 [板书]H++AlO2―+H2O 酸式电离 碱式电离 [讲]当向Al(OH)3溶液中加酸时,抑制酸式电离,促进碱式电离,若加入足量的酸,则Al(OH)3将完全以碱的形式电离,即Al(OH)3溶于酸中,当向Al(OH)3溶液加入碱时,抑制碱式电离,促进酸式电离,若加入足量的碱,则Al(OH)3完全以酸的形式电离,即Al(OH)3溶于碱中。 但是Al(OH)3不与弱酸反应,如向Al(OH)3浊液通入CO2不反应;也不与碱反应,如NH3·H2O,故实验室用NH3·H2O制备Al(OH)3 [板书](2)Al(OH)3 的制备 [投影实验3-7]Al(OH)3 的制备 实验步骤:在试管里另入10 mL 0.5 mol/L Al2(SO4)3 溶液,滴加氨水,生成白色胶状物质,继续滴加氨水,直到不再产生沉淀为止。当氨水过量时,沉淀不溶解,沉淀放在蒸发皿中加热,生成白色粉末。 [板书] Al2(SO4)3+6NH3 ·H2O ==2Al(OH)3↓+3 (NH4)2SO4 2Al(OH)3 [讲]在实验室可以用铝盐溶液与NH3 ·H2O 反应来制取Al(OH)3 [板书]Al3++3NH3 ·H2O == Al(OH)3 ↓+ 3NH4+ [投影总结]Mg(OH)2 、Al(OH)3 性质比较
[过]下面我们再介绍一种常见的Al的化合物。 [板书]3、硫酸铝钾(KAl(SO4)2) [讲]明矾就是带12个结晶水的硫酸铝钾,即KAl(SO4)2 ·12H2O [讲]KAl(SO4)2 是由两种不同的金属离子和一种酸根离子组成的化合物,是一种复盐。 [板书]复盐:KAl(SO4)2==K++Al3++2SO42― [讲]明矾溶液中滴入石蕊试液,变红,为什么? [板书]Al3++3H2O [小结]明矾水解所产生的胶状物Al(OH)3吸附能力强,可以吸附水里的杂质,并形成沉淀使水澄清。所以,明矾常作净水剂,但广泛使用铝盐净化水,可能导致脑损伤,造成严重的记忆力丧失,这是老年痴呆症特有的症状。使用时要切实注意,尽量扬长避短,才能使Al及其化合物对人类社会发展发挥出更为重要的作用。 |
展示样品 展示明矾晶体 Al3+ 水解 |
||||||||||||||||||||||
|
教学回顾: |
|||||||||||||||||||||||
教 案
|
课题:第三章 第二节 几种重要的金属化合物(三) |
授课班级 |
|
||||
|
课 时 |
|
|||||
|
教 学 目 的 |
知识 与 技能 |
1、掌握Fe3+ 的氧化性及检验方法,Fe3+ 与Fe2+的转变, 2、掌握Fe(OH)2 氧化成Fe(OH)3的过程 |
||||
|
过程 与 方法 |
1、教学中通过实验和探究,让学生对探究的方法有一些了解,在实验和探究过程中,积累一些科学假设和对比实验方法。 |
|||||
|
情感 态度 价值观 |
1、通过实验探究,让学生体会科学研究的乐趣,体验合作和动手的整个过程的积极的情绪。 |
|||||
|
重 点 |
Fe3+与Fe2+ 的之间转变 |
|||||
|
难 点 |
运用氧化还原反应的理论分析Fe3+ 与Fe2+ 的转变并进行实验设计和验证。 |
|||||
|
知 识 结 构 与 板 书 设 计 |
三、铁的重要化合物 1、铁的氧化物 2、铁的氢氧化物 氢氧化铁 ( iron(Ⅲ) hydroxide) 氢氧化亚铁 ( iron(Ⅱ) hydroxide) 3、铁盐和亚铁盐 (1) 常见的亚铁盐(绿色): FeCl2 、FeSO4 具有强还原性,必须现制现用 保存方法:加入少量铁粉 常见的铁盐(黄色): FeCl3、Fe2(SO4)3具有强氧化性 (2)Fe3+ 的检验 Fe3++3SCN-==Fe(SCN)3 (血红色) Fe2++2OH―==Fe(OH)2 (白色絮状沉淀) 4Fe(OH)2↓+O2+2H2O==4Fe(OH)3↓ 白色――灰绿色――红褐色 Fe3++3OH― ==Fe(OH)3 ↓(红褐色沉淀) (3) Fe3+的氧化性:亚铁盐和铁盐之间可以相互转化 |
|||||
|
教学过程 |
||||||
|
教学步骤、内容 |
教学方法、手段、师生活动 |
|||||
|
[引入]人类早在6000年前就开始利用铁,2000年前人类发明了从矿石里冶铁的方法。我国在春秋时期就开始冶铁、战国时期就开始炼钢。钢铁一直广泛地应用人类生活的方方面面。 新中国成立以前,我国的钢铁工业非常落后,生产的钢铁远不能满足生产和生活的需要,大量依靠进口,所以当时把铁钉称为“洋钉”,把铁皮称为“洋铁皮”。新中国成立后,我国的钢铁工业得到突飞猛进地发展,1996年我国的钢产量突破一亿吨。 [引]上一节我们学习了铁的化学性质。我们知道,Fe在O2中燃烧生成黑色的Fe3O4,除此之外,铁的氧化物还有两种------FeO、Fe2O3 这些铁的氧化物。有什么样的性质呢? [板书]三、铁的重要化合物 1、关于Na2CO3和NaHCO3的说法正确的是( ) A、它们的物质的量相等时,跟足量的盐酸反应,在相同状况时放出的CO2体积相同 B、它们的物质的量相等时,跟足量的盐酸反应,所消耗盐酸的物质的量相同 C、它们的质量相等时,在水中电离出相同数目的Na+ D、它们的质量相等时,与足量盐酸反应产生物质的量相等的CO2 2、五光十色的焰色――火焰发色剂 Sr(NO3)2――红色 NaNO3――黄色 Ba(NO3)2 ――绿色 LiNO3――紫红色 Mg、Al、Zn粉等在烧灼则产生耀眼的白光 火花――Al、Fe燃烧,爆炸时以散开的白色或黄色熔融粒子喷射而形成的。 浓烟――@及未反应的木炭粉等形成的。 燃放焰火虽可以给人带来欢乐,但引起的环境污染是相当严重的。 [小结]以上我们学习钠的化合物的知识以及一种科学检验元素的方法――焰色反应。 [自我评价] 1、火焰是靠内装的火药的引燃、发射的。 常用的黑火药用KNO3、S、C按一定的比例混合成,主要反应为 S+2KNO3+3C==K2S+3CO2↑+N2↑ 反应中放出大量的热,使生成的气体在高温下有限空间产生较强的压力,将焰色射送出去。 2.把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58克白色沉淀,在所得浊液中,逐滴加入0.5mol/l的盐酸,加入盐酸的体积与生成沉淀的质量关系如右图所示:
(a)混合物中NaOH的质量为 , (b)混合物中AlCl3质量为 (c)混合物中MgCl2质量为 , (d)P点表示盐酸的体积是 。 [板书]3、铁的转化关系 (1)铁三角应用 [投影]例1、把含有FeBr2、FeI2各a mol的稀溶液两份,分别通入一定量的Cl2,第一份溶液中有一半的I―被氧化成I2,第二份溶液中有一半的Br― 被氧化成Br2,两份奶入Cl2的物质的量之比( D ) A、1:1 B、1:2 C、1:3 D、1:5 [点击试题]1、在FeCl3、CuCl2和HCl的混合液中加入Fe粉,待反应结束,所剩余的固体滤出后能被磁铁吸引,则反应后溶液中存在较多的阳离子是( ) A、Cu2+ B、Fe3+ C、Fe2+ D、H+ [板书](2) 铁与稀HNO3 反应规律 当稀HNO3过量时,Fe+4HNO3==Fe(NO3)2 +NO↑+H2O [讲]若铁过量,则在上述反应基础上,继续反应, Fe+2Fe(NO3)3==3Fe(NO3)2 [板书]当铁粉过量时,3Fe+8HNO3==3Fe(NO3)2+2NO↑+4H2O [投影小结]根据Fe与HNO3的物质的量的变化,可分为以下三种情况:
≧ 3/8时,产物为Fe(NO3)2 若1/4≦ 但需要注意的是,无论Fe过量与否,被还原的HNO3占总消耗的HNO3的1/4 [板书](3) 守恒法在Fe计算中的综合应用 Ⅰ 质量守恒关系 [讲]质量守恒定律表示:参加化学反应的各种物质的质量总和,等于反应后生成物的各物质的质量总和。依据该定律常可得出下列解题时实用的等式: (1)反应物的质量总和=生成物的质量总和 (2)反应物减少的总质量=产物增加的总质量 (3)反应体系中固体质量的增加(或减少)等于气体质量的减少(或增加) [投影]例1、在2L硫酸铜和硫酸铁的混合溶液中,加入30g铁粉,最后得到2L0.25g·mol-1的硫酸亚铁溶液及26g固体沉淀物。分别求原混合溶液中硫酸铁和硫酸铜的物质的量浓度。 解:设硫酸铁、硫酸铜的物质的量分别为x和y。根据反应前后铁和铜的质量和相等得: 56g·mol-1×2x+64g·mol-1×y+30g =2L×0.25g·mol-1×56g·mol-1+26g? ?① 再由反应前后硫酸根离子的物质的量守恒得: ?3x+y=2L×0.25g·mol-1? ? ? ② 联立①②解得x=0.1mol,y=0.2mol。因此硫酸铁、硫酸铜的物质的量浓度分别为?0.05mol·L-1?和0.1mol·L-1。 [板书]Ⅱ元素守恒关系 [讲]在化学反应过程中,从某种意义上说可以认为是原子重新组合的过程,因此在反应过程中某种元素的原子,在反应前后必定保持两种守恒关系(均体现出原子个数相等):(1)原子的质量守恒;(2)原子的物质的量守恒。 [投影]例2、把铁、氧化铁、氧化铜的混合物粉末放入110mL4mol·L-1盐酸中,充分反应后产生896 mLH2(标准状况),残留固体1.28g。过滤,滤液中无Cu2+。将滤液加水稀释到200mL,测得其中c(H+)为0.4mol·L-1。试求原混合物的总质量。 [分析]
解:由Cu元素守恒可得: n(CuO)=n(Cu)=1.28g/64g·mol-1=0.02mol 由氯元素守恒可得: 2n(FeCl2)+n(HCl余)=n(HCl总)=0.44mol? 即?2n(FeCl2)+0.08mol=0.44mol,则n(FeCl2)=0.18mol。 又由氢元素守恒可得: 2n(生成H2O)+2n(H2)+n(HCl余)=n(HCl总)=0.44mol,解得反应产物中水的物质的量为n(生成H2O)=0.14mol。 由氧元素守恒可得: 3n(Fe2O3)+n(CuO)=n(生成H2O), 解得:n(Fe2O3)=0.04mol 最后由铁元素守恒可得: n(Fe)+2n(Fe2O3)=n(FeCl2) 解得:n(Fe)=0.1mol 综上可知,原混合物总质量为: 56g·mol-1×0.1mol+160g·mol-1×0.04mol+80g·mol-1×0.02mol=13.6g? [板书]Ⅲ 电荷守恒 [讲]在电解质溶液里或在离子化合物中,所含阴、阳离子的电荷数必定相等(电中性原理),即阳离子的物质的量(或物质的量浓度)×阳离子的电荷数=阴离子的物质的量(或物质的量浓度)×阴离子的电荷数。 [投影]例3、已知2Fe2++Br2=2Fe3++2Br-,当向100mL的FeBr2溶液中通入标准状况下的Cl23.36L,充分反应后测得形成的溶液中Cl-和Br-的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为多少? 解;由题供信息可知:Fe2+的还原性强于Br-的还原性;因此,通入Cl2后Fe2+应该全部被氧化成了Fe3+。据题意知反应后的溶液中只有Fe3+、Cl-、Br-,且n(Cl-)=n(Br-)=2n(Cl2)=2×3.36L/22.4L·mol-1=2×0.15mol。据电荷守恒原理,必有: 3n(Fe3+)=n(Cl-)×1+n(Br-)×1 解得:n(Fe3+)=0.2mol 又由铁元素守恒知n(Fe2+)=n(Fe3+)=0.2mol。故原FeBr2溶液的物质的量浓度为: 0.2mol/0.1L=2mol·L-1 [板书]Ⅳ 电子守恒关系 [讲]氧化还原反应的本质是参加反应的原子间的电子转移(包括电子得失和电子对的偏移)。在氧化还原反应过程中,氧化剂得到电子的总物质的量必定等于还原剂失去电子的总物质的量。在解有关氧化还原反应的试题(尤其是涉及多个氧化还原反应的综合题)时,运用电子守恒法可起到事半功倍的效果。 [投影]例4、将14g铁粉溶于1L稀硝酸中恰好完全反应,放出NO气体后称量所得溶液,发现比原溶液质量增加8g,则原溶液中硝酸的浓度为() A.0.4mol·L-1B.0.6mol·L-1 C.0.8mol·L-1D.1.0mol·L-1 解:按常规解本题需先判断出反应中同时生成了+2、+3价的铁,然后再根据方程式求解。若运用守恒原理则可避开繁琐的讨论和方程式的书写。 假设铁单质在反应中被氧化成+n价,由题意有: Fe - ne-→Fe(NO3)n→nHNO3 (反应中作酸用的) 1 n n (14/56)mol 0.25nmol 0.25nmol 由题意知,产生气体NO的质量为14g-8g=6g,物质的量为6g/30g·mol-1=0.2mol。 则有HNO3(反应起氧化剂作用的)+3e-→ NO 1 3 1 0.2mol 0.6mol 0.2mol? 据电子的守恒原理可得0.25n=0.6;又由氮元素守恒原理可推知,反应中共消耗硝酸的物质的量为: 0.25nmol+0.2mol=0.8mol 故选C。 [点击试题]1、在100mL的FeBr2溶液中,通入2.24L的标准状况下的氯气,充分反应后,溶液中有1/3的Br-被氧化成溴单质。求原FeBr2溶液的物质的量浓度。 解:设FeBr2溶液的物质的量浓度为xmol·L-1,根据氧化还原反应中氧化剂和还原剂得失电子数相等的原则知,Cl2所得电子的物质的量应等于Fe2+和Br-所失电子的物质的量之和。则有: 2.24L/22.4L·mol-1×2=0.1x×1+(0.1x/3)×2×1? 解得x=1.2。因此原FeBr2溶液的物质的量浓度为1.2mol·L-1。 [板书]Ⅴ 体积守恒关系 [投影]例5、将5.6g铁粉与6.4g硫粉在隔绝空气的条件下加热充分反应后冷却至室温,再在其固体中加入足量的稀硫酸反应至固体不再溶解,所制得的气体在0℃、1.01×105Pa下的体积约为( )。 A.2.24L B.2.34LC.2.80L D.4.48L 解:加热时发生的化学反应为: Fe+S=FeS 与足量稀硫酸发生的化学反应可能有: Fe+H2SO4=FeSO4+H2↑ FeS+H2SO4=FeSO4+H2S↑ 从上述反应方程式分析可发现如下变化关系:Fe→FeSO4→H2;Fe→FeS→H2S。即1molFe经充分反应后,最终能生成1mol气体(可能是H2S,也可能是H2和H2S的混合气),而与硫粉的质量多少无关。因题中Fe粉的物质的量为0.1mol,所以,生成气体也恒为0.1mol,标准状况下的体积为2.24L。应选A。 [点击试题]1、已知有关物质及离子的氧化性顺序为:浓硫酸>Fe3+>H+。现将30g铁粉(过量)与44.0mL浓硫酸在加热条件下充分反应,共收集到11.2L(标准状况)气体,其质量为19.6g。试计算: 1)浓硫酸的物质的量浓度; (2)反应后剩余铁粉的质量。 解:设参加反应的铁粉的物质的量为x,由题意知,混合气体的成分应为SO2、H2的混合气,物质的量总和为11.2L/22.4L·mol-1=0.5mol,则混合气体的平均摩尔质量为: 19.6g÷0.5mol=39.2g·mol-1
所以,混合气体中的SO2、H2体积比(即物质的量之比)为:37.2∶24.8=3∶2,即生成的SO2、H2的物质的量分别为0.3mol和0.2mol。 Fe-2e---→Fe2+ H2SO4+2e---→SO2 2H++2e---→H2 根据电子守恒原理可得: ?2x=0.3mol×2+0.2mol×2=1.0mol 解得:?x=0.5mol 实际参加反应的铁粉质量为0.5mol×56g·mol-1=28g,由质量守恒原理知剩余铁粉质量为30g-28g=2g。 又由铁元素守恒知最后溶液中FeSO4的物质的量也应为0.5mol。 又据硫元素守恒知: ?n(H2SO4)=n(FeSO4)+n(SO2) =0.5mol+0.3mol=0.8mol 浓硫酸的物质的量浓度为: 0.8mol/0.044L=18.2mol·L-1 [总结]涉及铁元素及其化合物的计算题很多,解这类题时,建议解题者首先考虑“守恒”原理的应用,具备“守恒意识”是快速准确解答此类题的关键,因为大部分情况下,发生在溶液中的反应均具备上述诸种守恒关系。 |
38.7% 8克 CO2:4.4 H2O :7.2 CD C 19<M<51,R为Na 或K 综合性问题,假设法、差量法、分类讨论法和代数方程组法的综合性运用。 H++CO32― == HCO3― H++HCO3―=== H2O +CO2 ↑ C C D (a)混合物中NaOH的质量为 2g ,(b)混合物中AlCl3质量为0.6675 g (c)混合物中MgCl2质量为 0.95g , (d)P点表示盐酸的体积是 90mL 。 C 若根据题供信息“有关物质及离子的氧化性顺序为:浓硫酸>Fe3+>H+”分析解题,那么应该根据氧化还原反应的“次序规律”分别考虑铁粉依次与浓硫酸、Fe3+、H+(即稀硫酸)的反应,其实,这是一条陷阱信息,只要抓住“铁粉过量”这一关键信息,便不难推知:最后的溶液中必定只有FeSO4这一种溶质。那么,综合运用“电子守恒”、“质量守恒”及“元素守恒”即可巧妙解答此题。 |
|||||
|
教学回顾: |
||||||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com