
2、 氧化还原反应中电子转移的表示方法
氧化还原反应中电子转移的表示方法
(1) 双线桥法---表示电子得失结果
(2) 单线桥--表示电子转移情况

1、2、3反应中元素化合价发生了变化,所以他们是氧化还原反应;4、5反应中元素化合价没有发生变化,所以是非氧化还原反应。)
[过]为什么氧化还原反应前后元素的化合价发生变化?其本质原因是什么呢?
[讲]以2Na +Cl2==2NaCl 为例
[投影]
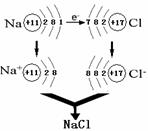
[讲]2Na +Cl2==2NaCl ,反应前后化合价发生了变化,是个氧化还原反应。钠原子最外层有一个电子,在反应中易失去一个电子,成为稳定的钠离子;而氯原子最外层有7个电子,反应中易得到一个电子,成为稳定的氯离子,钠离子和氯离子通过静电作用形成离子化合物氯化钠。这个过程中电子通过失与得由钠原子转移到氯原子。
[讲]在形成离子化合物时,某元素的原子失去电子,则使元素化合价升高,某元素的原子得到电子,则此元素化合价最低。那么得失电子会使元素化合价发生了变化。
电子由一种元素的原子转移到另一种元素的原子,带负电荷电子的移动使电路中产生了电流,电流计指针发生了偏转,有关它的原理我们将在必修2中继续学习。
[问]由上述可知,形成离子化合物时,化合价变化的原因是什么?
(Na元素原子失电子,则化合价升高,Cl元素原子得电子,则化合价降低。即化合价的变化在形成离子化合物时是由于元素得失电子引起的)
[板书]
失电子总数=化合价升高总数==得电子总数==化合价降低总数。
[讲]同样,我们再来分析H2 +Cl2===2HCl 。在氢气和氯气反应中,由于生成物氯化氢是共价化合物,在反应过程中,哪一种元素的原子都没有失去或完全得到电子,它们之间只有共用电子对的偏移,且共用电子对偏离于氢原子,而偏向于氯原子,因此氢原子由0价升高到+1价被氧化,氯元素从0价降低到-1价,被还原。所以,共用电子对的偏移也可以使元素化合价发生变化。
[板书]3、氧化还原反应的实质------电子的转移(电子的得失或共用电子对的偏移
[总结]让学生总结本节课所学主要内容。
|
|
得氧失氧观点 |
化合价升降观点 |
电子转移观点 |
|
氧化反应 |
得到氧的反应 |
化合价升高的反应 |
失去电子的反应 |
|
还原反应 |
失去氧的反应 |
化合价降低的反应 |
得到电子的反应 |
|
氧化还原的关系 |
得氧失氧同时发生 |
化合价升降同时发生(且升降总数相等) |
得失电子同时发生(且得失电子总数相等) |
|
氧化还原反应 |
有氧得失的反应 |
有化合价升降的反应 |
有电子转移的反应 |
[板书]口诀:化合价升高,失电子,被氧化;
化合价降低,得电子,被还原
教 案
|
课题:第二章 第三节 氧化还原反应(二) |
授课班级 |
|
||
|
课 时 |
|
|||
|
教 学 目 的 |
知识 与 技能 |
1、掌握四种基本反应类型和氧化还原反应间的关系,理解氧化剂和还原剂的概念; 2、了解氧化还原反应在日常生活、生产中的应用; |
||
|
过程 与 方法 |
1、通过氧化还原反应概念的教学,培养学生准确描述概念、深刻理解概念、比较辨析概念的能力; 2、通过对氧化还原反应概念认识的过程,体会科学探究的基本方法,提高科学探究能力。 |
|||
|
情感 态度 价值观 |
1、通过氧化还原反应概念的演变,培养学生用发展的观点、科学的态度、探索的精神学习化学; 2、通过创设问题情景,引导学生积极思维,激发学生学习化学的兴趣和求知欲望。 |
|||
|
重 点 |
氧化还原反应的本质 |
|||
|
难 点 |
氧化还原反应的概念的应用 |
|||
|
知 识 结 构 与 板 书 设 计 |
4、氧化还原反应与四种基本反应类型的关系 二、氧化剂和还原剂 1、氧化剂和还原剂(反应物) 氧化剂:得电子(或电子对偏向)的物质------氧化性 还原剂:失电子(或电子对偏离)的物质------还原性 氧化产物:氧化后的生成物 还原产物:还原后的生成物。
2、氧化还原反应的判断依据-----有元素化合价变化 [问]请判断投影的五个反应都是否是氧化还原反应? 1、氧化反应( oxidation reaction):元素化合价升高的反应 还原反应( reduction reaction):元素化合价降低的反应 氧化还原反应:凡有元素化合价升降的化学反应就是 3、CuO +H2 ===Cu +H2O (在反应1中,铜元素化合价降低,碳元素化合价升高;在反应2中,氢元素化合价降低,碳元素化合价升高;在反应3中铜元素化合价降低,氢元素化合价升高,) [讲]由此可知,有元素化合价升高的反应是氧化反应,有元素化合价降低的反应是还原反应,氧化与还原这两个对立的过程相互依存而统一于一个氧化还原反应之中,同时发生而且不可以分离。总的来说,在化学反应中,物质的某些元素的化合价在反应前后发生了变化就是氧化还原反应。 [板书]一、氧化还原反应 2、H2O +C==H2 +CO 1、2CuO +C===2Cu +CO2 ↑ 5、碳酸钙的分解反应 [问]反应2Cu +O2==2CuO 除属化合反应外还属于什么反应类型? (氧化反应) [问]什么叫氧化反应? (物质跟氧发生的化学反应称为氧化反应) [问]请判断下列反应中H2 发生了什么反应?CuO+H2 ==H2O +Cu (H2 夺取了CuO 中的氧并与氧结合生成了H2O ,发生了氧化反应) [问]那么CuO 发生了什么反应? (CuO 失去了氧,发生的是还原反应) [讲]在这个反应中,氧化铜失去氧变成单质铜,发生了还原反应;碳得到了氧变成了二氧化碳,发生了氧化反应。也就是说,氧化反应和还原反应是同时发生的,这样的反应称为氧化还原反应。 [思考与交流]请分析下列3个氧化还原反应中各种元素的化合价在反应前后有无变化,讨论氧化还原反应与元素化合价的升降有什么关系。 4、氯化钠溶液与硝酸银溶液的反应 3、铁与硫酸铜溶液的反应 同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 |