
3.燃油税改革调节生产,促使企业依据市场开发低油耗产品
2.燃油税改革,有利于降低中低收入者购车的费用,从而促进汽车的消费。
26.(9分)复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH值:
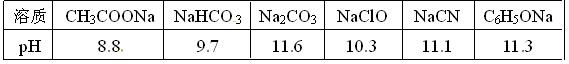 复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3===2CH3COONa+CO2↑+H2O 若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请判断下列反应不能成立的是___________(填编号)。
复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3===2CH3COONa+CO2↑+H2O 若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请判断下列反应不能成立的是___________(填编号)。
A.CO2+H2O
+2NaClO=Na2CO3+2HClO
B.CO2+H2O
+NaClO=NaHCO3+HClO
C.CO2 +H2O +C6H5ONa NaHCO3+C6H5OH
D.CO2 +H2O +2C6H5ONa
NaHCO3+C6H5OH
D.CO2 +H2O +2C6H5ONa Na2CO3+2C6H5OH
E.Na2CO3+C6H5OH
Na2CO3+2C6H5OH
E.Na2CO3+C6H5OH NaHCO3+C6H5ONa
F.CH3COOH+NaCN=CH3COONa+HCN
NaHCO3+C6H5ONa
F.CH3COOH+NaCN=CH3COONa+HCN
(2)根据前述信息判断,常温下浓度均为0.05 mol/L的下列5种物质的溶液中,pH最小的是_____(填编号),其pH值为_______(填数值);pH最大的是____(填编号)。
①HCN ②CH3COOH ③HClO4 ④HClO ⑤H2SO4
(3)一些复分解反应的发生还遵循其它的规律。下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液
②侯氏制碱法中,向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打晶体
③蒸发KCl和NaNO3混合溶液,首先析出NaCl晶体
请根据上述反应,总结出复分解反应发生的另一规律: ;
(4)根据(3)中结论,现将KI溶液和AgCl固体混合搅拌,则可能会观察到的现象是 ,反应的离子方程式为 。
25.(10分)由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、NH4+、Mg2+、Cu2+、Ba2+、C1-、SO42-、CO32-。将该混合物溶于水后得无色澄清溶液,现分别取3份100mL该溶液进行如下实验:
|
实验 序号 |
实验内容 |
实验结果 |
|
a |
加AgNO3溶液 |
有白色沉淀生成 |
|
b |
加足量NaOH溶液并加热 |
收集到气体1.12L(已折算成标准 状况下的体积) |
|
c |
加足量BaC12溶液时,对所得沉淀进行 洗涤、干燥、称量;再向沉淀中加足量 稀盐酸,然后干燥、称量 |
第一次称量读数为6. 27g,第二次 称量读数为2.33g |
试回答下列问题:
(1)该混合物中一定不存在的离子是 。
(2)试写出实验b发生反应的离子方程式 。
(3)溶液中一定存在的阴离子及其物质的量浓度(可不填满):
|
阴离子符号 |
物质的量浓度(mol·L-1) |
|
|
|
|
|
|
|
|
|
(4)判断混合物中是否存在K+并说明理由? 。
24.(8分)已知X、Y、Z都是短周期的元素,它们的原子序数依次递增,X原子的电子层数与它的核外电子总数相同,而Z原子的最外层电子数是次外层电子数的三倍,Y和Z可以形成两种以上的气态化合物,则
(1) Y是 、Z是 (填元素名称)。
(2) 由Y和Z组成,且Y和Z质量比为7∶20的化合物的化学式(分子式)是 。
(3) 由X、Y、Z中的两种元素组成,且与X2Z分子具有相同电子数的两种离子是(离子符号) 和 。
(4) X、Y、Z可以形成一种盐,此盐中X、Y、Z元素的原子的个数比为4∶2∶3,该盐水溶液显 性,原因是(用离子方程式表示) 。
10.0 mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是 。
②b中反应所产生的I2的物质的量是 mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)
_________________mg/kg。
22(8分)用Cl2消毒会使饮用水中的有机物发生氯化,生成有机氯化合物,于人体有害。世界环保联盟即将全面禁止用氯气对饮用水消毒。建议推广采用广谱性高效消毒剂ClO2气体。
(1)目前,欧洲一些国家用NaClO3氧化浓盐酸制取ClO2,同时有Cl2生成,且Cl2体积为ClO2的一半,该反应的化学方程式是: 。
(2)我国最近研究成功用氯气氧化亚氯酸钠(NaClO2,N2保护下)制ClO2,其反应的化学方程式为: ,
这一反应的优点是: 。
(3)在H2SO4存在的条件下,用Na2SO3还原NaClO3也可制ClO2,其反应的化学方程式为:
。
23.(12分)市场销售的某种食用精制盐包装袋上有如下说明:
|
产品标准 |
GB5461 |
|
产品等级 |
一级 |
|
配料 |
食盐、碘酸钾、抗结剂 |
|
碘含量(以I计) |
20-50 mg/kg |
|
分装日期 |
|
|
分装企业 |
|
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处):___KIO3+___KI+___H2SO4 =___K2SO4+___I2+___H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是 。
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液; c.分离出下层液体。
以上设计中遗漏的操作及上述步骤中的位置是_________________________________。
(3)已知:I2+2S2O32 - = 2I-+S4O62 -。某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3 mol/L的Na2S2O3溶液
21.amolFeS与bmolFe3O4投入到VL cmol/L的硝酸溶液中恰好完全反应,假设只产生NO气体。所得澄清溶液的成分是Fe(NO3)3和H2SO4的混合液,则反应中未被还原的硝酸为
A.(a+3b)mol B.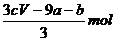
C.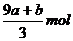 D.(cV-3a-9b)mol
D.(cV-3a-9b)mol
Ⅱ卷(非选择题 共47分)
20.铅的冶炼大致过程如下:
①富集:将方铅矿(PbS)进行浮选;
②焙烧:2PbS+3O2  2PbO+2SO2;
2PbO+2SO2;
③制粗铅:PbO+C Pb+CO;PbO+CO
Pb+CO;PbO+CO Pb+CO2。
Pb+CO2。
下列说法正确的是
A.浮选法富集方铅矿的过程属于化学变化
B.方铅矿焙烧反应中,PbS是还原剂,还原产物只有PbO
C.整个冶炼过程中,制取1molPb共转移2mol电子
D.将1molPbS完全冶炼成Pb理论上至少需要6g碳
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com