
2.(构造原理)
了解多电子原子中核外电子分层排布遵循的原理,能用电子排布式表示1-36号元素原子核外电子的排布.
(1).原子核外电子的运动特征可以用电子层、原子轨道(亚层)和自旋方向来进行描述.在含有多个核外电子的原子中,不存在运动状态完全相同的两个电子.
(2).原子核外电子排布原理.
①.能量最低原理:电子先占据能量低的轨道,再依次进入能量高的轨道.
②.泡利不相容原理:每个轨道最多容纳两个自旋状态不同的电子.
③.洪特规则:在能量相同的轨道上排布时,电子尽可能分占不同的轨道,且自旋状态相同.
洪特规则的特例:在等价轨道的全充满(p6、d10、f14)、半充满(p3、d5、f7)、全空时(p0、d0、f0)的状态,具有较低的能量和较大的稳定性.如24Cr [Ar]3d54s1、29Cu [Ar]3d104s1.
(3).掌握能级交错图和1-36号元素的核外电子排布式.
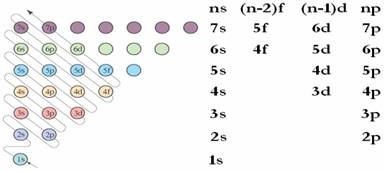
①根据构造原理,基态原子核外电子的排布遵循图⑴箭头所示的顺序。
②根据构造原理,可以将各能级按能量的差异分成能级组如图⑵所示,由下而上表示七个能级组,其能量依次升高;在同一能级组内,从左到右能量依次升高。基态原子核外电子的排布按能量由低到高的顺序依次排布。
例3.表示一个原子在第三电子层上有10个电子可以写成
A.310 B.3d10 C.3s23p63d2 D. 3s23p64s2
例4.下列电子排布中,原子处于激发状态的是
 A.1s22s22p5
B. 1s22s22p43s2
A.1s22s22p5
B. 1s22s22p43s2
C. 1s22s22p63s23p63d44s2 D. 1s22s22p63s23p63d34s2
例5.下列关于价电子构型为3s23p4的粒子描述正确的是
A.它的元素符号为O
B.它的核外电子排布式为1s22s22p63s23p4
C.它可与H2生成液态化合物
 D.其电子排布图为:
D.其电子排布图为:
1s 2s 2p 3s 3p
例6.按所示格式填写下表有序号的表格:
|
原子序数 |
电子排布式 |
价层电子排布 |
周期 |
族 |
|
17 |
① |
② |
③ |
④ |
|
⑤ |
1s22s22p6 |
⑥ |
⑦ |
⑧ |
|
⑨ |
⑩ |
3d54s1 |
⑾ |
ⅥB |
例6.①.1s22s22p63s23p5 ②.3s23p5 ③.3 ④.ⅦA ⑤.10 ⑥.2s22p6
⑦.2 ⑧.0 ⑨.24 ⑩.1s22s22p63s23p63d54s1 ⑾.4
例7.(1).砷原子的最外层电子排布式是4s24p3,在元素周期表中,砷元素位于__________
周期 族;最高价氧化物的化学式为 ,砷酸钠的化学式是 .
(2).已知下列元素在周期表中的位置,写出它们最外层电子构型和元素符号:
①.第4周期ⅣB族 ;
②.第5周期ⅦA族 .
例7.(1).4 ⅤA As2O5 Na3AsO4
(2).①.3d24s2 Ti ②.5S25p5 I
1.电子云:用小黑点的疏密来描述电子在原子核外空间出现的机会大小所得的图形叫电子云图.离核越近,电子出现的机会大,电子云密度越大;离核越远,电子出现的机会小,电子云密度越小.
电子层(能层):根据电子的能量差异和主要运动区域的不同,核外电子分别处于不同的电子层.原子由里向外对应的电子层符号分别为K、L、M、N、O、P、Q.
原子轨道(能级即亚层):处于同一电子层的原子核外电子,也可以在不同类型的原子轨道上运动,分别用s、p、d、f表示不同形状的轨道,s轨道呈球形、p轨道呈纺锤形,d轨道和f轨道较复杂.各轨道的伸展方向个数依次为1、3、5、7.
例1.下列关于氢原子电子云图的说法正确的是
A.通常用小黑点来表示电子的多少,黑点密度大,电子数目大
B.黑点密度大,单位体积内电子出现的机会大
C.通常用小黑点来表示电子绕核作高速圆周运动
D.电子云图是对运动无规律性的描述
例2.下列有关认识正确的是
A.各能级的原子轨道数按s、p、d、f的顺序分别为1、3、5、7
B.各能层的能级都是从s能级开始至f能级结束
C.各能层含有的能级数为n -1
D.各能层含有的电子数为2n2
29.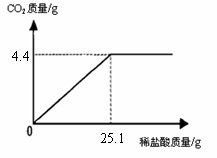 (7分) 某班一次社会实践活动是到连云港碱厂参观,该厂主要产品之一是小苏打(碳酸氢钠)。参观结束,同学们带回一些化验室里废弃的小苏打样品,来测定其中碳酸氢钠的质量分数(假设该样品中只含有氯化钠一种杂质)。取样品9.3
g逐滴加入稀盐酸,生成CO2气体的质量与滴加稀盐酸的质量关系如右图所示,求:(计算结果用百分数表示,保留到小数点后一位数字)
(7分) 某班一次社会实践活动是到连云港碱厂参观,该厂主要产品之一是小苏打(碳酸氢钠)。参观结束,同学们带回一些化验室里废弃的小苏打样品,来测定其中碳酸氢钠的质量分数(假设该样品中只含有氯化钠一种杂质)。取样品9.3
g逐滴加入稀盐酸,生成CO2气体的质量与滴加稀盐酸的质量关系如右图所示,求:(计算结果用百分数表示,保留到小数点后一位数字)
(1)样品中碳酸氢钠的质量分数。
(2)恰好完全反应时,所得溶液中溶质的质量分数。
连云港市2009年高中段学校招生统一文化考试
28.(12分) 某化学兴趣小组有一次活动的内容是:对一包干燥的红色粉末组成进行探究。请你参与并回答有关问题。
[教师提醒]它由Cu 、Fe2O3 、Fe(OH)3三种固体中的一种或两种组成。
[提出猜想]红色粉末可能的组成有:
①只有Cu ②只有Fe2O3
③只有 Fe(OH)3 ④是Fe2O3 、Fe(OH)3的混合物
⑤是Cu 、Fe2O3的混合物 ⑥是Cu 、Fe(OH)3的混合物
 [资料获悉](1)2Fe(OH)3 Fe2O3
+3H2O
[资料获悉](1)2Fe(OH)3 Fe2O3
+3H2O
(2)白色无水CuSO4遇水变蓝
 (3)Cu在FeCl3溶液中发生反应:2FeCl3+Cu 2FeCl2+CuCl2
(3)Cu在FeCl3溶液中发生反应:2FeCl3+Cu 2FeCl2+CuCl2
 [探究思路]利用物质的性质不同设计实验加以甄别,先分别探究其中是否含有Fe(OH)3 、Cu等,逐步缩小范围,然后再选择适当的试剂和方法通过实验探究其组成。
[探究思路]利用物质的性质不同设计实验加以甄别,先分别探究其中是否含有Fe(OH)3 、Cu等,逐步缩小范围,然后再选择适当的试剂和方法通过实验探究其组成。
(装置内空气中的水蒸气、CO2忽略不计)
[实验探究]
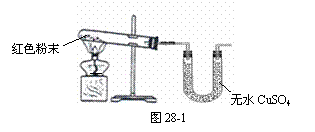
(1)甲同学取适量红色粉末装入试管中,按图28-1
进行实验。结果无水CuSO4没有变蓝,从而排除
猜想中的 ▲ 。(填猜想中的序号)
(2)在甲同学实验结论的基础上,乙同学另取少量红色粉末于试管中,滴加足量稀盐酸,振荡后观察,发现固体全部溶解,溶液变色。乙同学认为可以排除猜想中的①和⑤,而丙同学认为只能排除猜想①,你认为 ▲ 的观点正确(填“乙”或“丙”)。
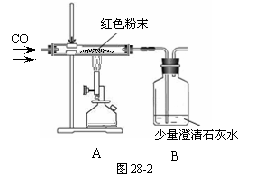 (3)丁同学为进一步确定红色粉末的组成,称取该粉末5.0g装入硬质玻璃管中,按图28-2在通风橱中进行实验。开始时缓缓通入CO气体,过一段时间后再加热使其充分反应。待反应完全后,停止加热,仍继续通CO气体直至玻璃管冷却。反应前后称量相关装置和物质的总质量,其数据如下表:
(3)丁同学为进一步确定红色粉末的组成,称取该粉末5.0g装入硬质玻璃管中,按图28-2在通风橱中进行实验。开始时缓缓通入CO气体,过一段时间后再加热使其充分反应。待反应完全后,停止加热,仍继续通CO气体直至玻璃管冷却。反应前后称量相关装置和物质的总质量,其数据如下表:
|
|
反应前 |
反应后 |
|
Ⅰ 组 |
玻璃管和红色粉末的总质量为37.3 g |
玻璃管和固体物质的总质量为36.1 g |
|
Ⅱ 组 |
洗气瓶和所盛溶液 的总质量为180.0 g |
洗气瓶和瓶中物质 的总质量为183.1 g |
[交流讨论]
(1)在装置A中先通CO气体的作用是 ▲ 。
(2)应该选择 ▲ 组的实验数据计算来确定红色粉末的组成。最终计算结果表明:该红色粉末的组成是猜想中的第 ▲ 组(填序号)。
(3)写出A装置中发生反应的化学方程式 ▲ ;实验中观察到A装置中的现象为 ▲ 。
(4)为了防止溶液倒吸,本实验停止加热前是否需要先断开A和B的连接处? ▲ (填“需要”或“不需要”),理由是 ▲ 。
[反思评价] 戊同学指出:从环保角度,图28-2装置有严重不足之处。你认为应该如何改进? ▲ 。
[拓展延伸]有同学提出丁同学上述实验中的CO还可以用H2代替,并将图28-2中B装置换成盛有碱石灰(生石灰和氢氧化钠固体混合物)的干燥管,来确定该红色粉末的组成,你认为是否可行? ▲ (填“可行”或“不可行”)。
27.(7分) 今年我市九年级化学实验操作考查的方法是由考生抽签确定考题,小华同学抽到的题目是“以鸡蛋壳和稀盐酸为原料制取CO2”。小华完成该实验的部分操作过程如下图所示:
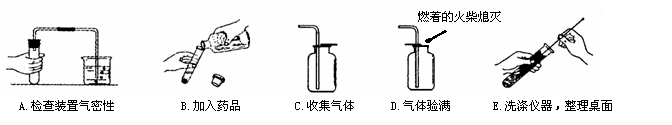
(1)小华上述操作过程中有明显错误的是 ▲ (填字母序号)。
(2)操作A中,小华松开手片刻后,看到烧杯内的导管中形成一段 ▲ ,证明装置不漏气。
(3)若要验证鸡蛋壳的主要成分CaCO3中的Ca2+,只要在反应后溶液中逐滴加入 ▲ 溶液,观察到 ▲ 现象即可(鸡蛋壳中的杂质不干扰反应现象)。若所加试剂正确,但实验刚开始阶段却观察不到应有的现象,则原因是 ▲ 。
(4)若将鸡蛋壳换为锌粒,利用上述实验中涉及到的仪器和药品可以制取另一种常见气体,该反应的化学方程式是 ▲ 。
26.(9分) A-J均为初中化学中的常见物质,已知A、B的组
成元素相同,B是最常用的溶剂;常温下C、E均为无刺激性
气味的气体,且C为单质;A、B、D、E、J均为氧化物,J
是常用的干燥剂;F、G是粗盐中含有较多的可溶性杂质,它
们的阳离子是硬水中含有较多的金属离子;H、I均为白色难
溶于水的盐,其中H能溶于酸,而I却不溶于酸。A-J之间
 的转化关系如图所示(其中“
”代表物质之间的转化关
的转化关系如图所示(其中“
”代表物质之间的转化关
系,部分反应物、生成物和反应条件已略去)。
(1)写出下列物质的化学式:B ▲ ;D ▲ ;I ▲ ;J ▲ 。
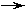 (2)写出下列转化的化学反应方程式:A C ▲ ; H G ▲
;
(2)写出下列转化的化学反应方程式:A C ▲ ; H G ▲
;
 判断:H G的反应属于基本反应类型中的
▲ 反应。
判断:H G的反应属于基本反应类型中的
▲ 反应。
25. (8分) 2009年春节联欢晚会上,刘谦的魔术表演激起了人们强烈的好奇心,并在全国范围内掀起了魔术表演的热潮。在学校科技节活动中,一位九年级同学给低年级同学表演了一组化学小魔术,请你利用所学化学知识揭开其中之谜。
(8分) 2009年春节联欢晚会上,刘谦的魔术表演激起了人们强烈的好奇心,并在全国范围内掀起了魔术表演的热潮。在学校科技节活动中,一位九年级同学给低年级同学表演了一组化学小魔术,请你利用所学化学知识揭开其中之谜。
魔术一“奇花变色”
道具如图25-1所示,该魔术中可观察到“铁树”上浸有无色酚酞试液的棉团由白色变为 ▲ 色。该魔术中没有涉及的性质是 ▲ (填字母序号)。
A.氨分子是不断运动的 B.氨分子有一定质量
C.浓氨水具有挥发性 D.氨气的水溶液显碱性
魔术二“瓶吞鸡蛋”
道具如图25-2所示,将注射器中NaOH浓溶液注入瓶中,片刻后会看到鸡蛋被“吞”入瓶中。该魔术中涉及的化学反应为 ▲ (用化学方程式表示)。
魔术三“水中生火”
道具如图25-3所示,当通过导管向热水中通入氧气时,白磷在水下燃烧。该魔术说明燃烧需要的条件为:①可燃物;②达到燃烧所需要的 ▲ ;③有充足的 ▲ 。
魔术四“‘清水’变‘牛奶’”
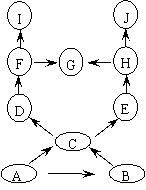 道具如图25-4所示,当A溶液加到烧杯中,无色溶液变成白色浊液。若A为酸溶液,则A、B的可能组合:A为 ▲ ;B为 ▲
。(只需写一组)
道具如图25-4所示,当A溶液加到烧杯中,无色溶液变成白色浊液。若A为酸溶液,则A、B的可能组合:A为 ▲ ;B为 ▲
。(只需写一组)
24.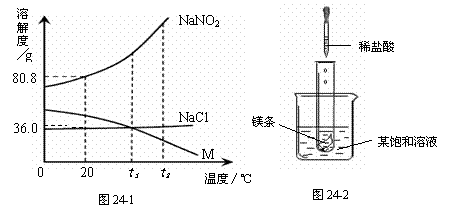 (6分) NaNO2(亚硝酸钠)、NaCl和物质M (不含结晶水)的溶解度曲线如图24-1所示,请根据图像和有关信息回答下列问题:
(6分) NaNO2(亚硝酸钠)、NaCl和物质M (不含结晶水)的溶解度曲线如图24-1所示,请根据图像和有关信息回答下列问题:
(1)t2 ℃时,NaNO2、NaCl
和M的溶解度由大到小的顺
序是 ▲ 。
(2)如图24-2所示,当往试
管中加入5mL稀盐酸时,试
管内立刻产生大量气泡,同时
放热使烧杯中饱和溶液变浑浊
(不考虑水分蒸发)。请判断:
该饱和溶液中的溶质是NaNO2、
NaCl和M中的 ▲ 。
(3)分别将NaNO2、NaCl和M的饱和溶液从t2℃降温到t1℃时,三种溶液中溶质的质量分数由大到小的顺序是 ▲ 。
(4)NaNO2有毒,其外观和咸味与食盐很相似,因此要防止因误食NaNO2而发生中毒事故。为了区别NaNO2、NaCl固体,某化学兴趣小组同学查阅资料获得如下信息: NaNO2的水溶液呈碱性,NaCl的水溶液呈中性;NaNO2熔点为271 ℃,NaCl熔点为801 ℃。
① 小明同学设计的鉴别实验方案如下:
20℃时分别取NaNO2、NaCl各5.0g于两只小烧杯中,分别加入10mL水(水的密度近似看作1g/cm3),用玻璃棒充分搅拌后观察。你认为此方案是否可行 ▲ (填“可行”或“不可行”)。
② 该小组其他同学又设计出与小明不同的实验方案,并获得成功。你认为该方案可能是 ▲ (只填写一种方案并简单叙述)。
23. (3分) “徐福记沙琪玛”是人们喜爱的食品之一,右图
(3分) “徐福记沙琪玛”是人们喜爱的食品之一,右图
是其标签中的一部分,其中小麦粉、鸡蛋、食用棕榈油
依次富含六大营养素(蛋白质、糖类、油脂、维生素、
无机盐、水)中的 ▲ 、 ▲ 、 ▲ 。
22.(3分) 材料是时代进步的标志,材料的应用与发展,大大方便了人类的生活。以下材料:①不锈钢 ②塑料 ③棉花 ,其中属于
(1)有机合成材料的是 ▲ ;(2)金属材料的是 ▲ ;(3)天然纤维的是 ▲ 。(填序号)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com