
6.理解金属键的含义,能用金属键的自由电子理论解释金属的一些物理性质.知道金属晶体的基本堆积方式,了解常见金属晶体的晶胞结构(晶体内部空隙的识别、与晶胞的边长等晶体结构参数相关的计算不作要求).
(1).金属键:金属离子和自由电子之间强烈的相互作用.
请运用自由电子理论解释金属晶体的导电性、导热性和延展性.
|
晶体中的微粒 |
导电性 |
导热性 |
延展性 |
|
金属离子和自由电子 |
自由电子在外加电场的作用下发生定向移动 |
自由电子与金属离子碰撞传递热量 |
晶体中各原子层相对滑动仍保持相互作用 |
(2)①金属晶体:通过金属键作用形成的晶体.
②金属键的强弱和金属晶体熔沸点的变化规律:阳离子所带电荷越多、半径越小,金属键越强,熔沸点越高.如熔点:Na<Mg<Al,Li>Na>K>Rb>Cs.金属键的强弱可以用金属的原子化热来衡量.
 例28.物质结构理论推出:金属晶体中金属离子与自由电子之间的强烈相互作用,叫金属键.金属键越强,其金属的硬度越大,熔沸点越高,且据研究表明,一般说来金属原子半径越小,价电子数越多,则金属键越强.由此判断下列说法错误的是
例28.物质结构理论推出:金属晶体中金属离子与自由电子之间的强烈相互作用,叫金属键.金属键越强,其金属的硬度越大,熔沸点越高,且据研究表明,一般说来金属原子半径越小,价电子数越多,则金属键越强.由此判断下列说法错误的是
A.镁的硬度大于铝 B.镁的熔沸点低于钙 C.镁的硬度大于钾 D.钙的熔沸点高于钾
例29.金属的下列性质中和金属晶体无关的是
A.良好的导电性 B.反应中易失电子
C.良好的延展性 D.良好的导热性
5.了解原子晶体的特征,能描述金刚石、二氧化硅等原子晶体的结构与性质的关系.
(1).原子晶体:所有原子间通过共价键结合成的晶体或相邻原子间以共价键相结合而形成空间立体网状结构的晶体.
(2).典型的原子晶体有金刚石(C)、晶体硅(Si)、二氧化硅(SiO2).
金刚石是正四面体的空间网状结构,最小的碳环中有6个碳原子,每个碳原子与周围四个碳原子形成四个共价键;晶体硅的结构与金刚石相似;二氧化硅晶体是空间网状结构,最小的环中有6个硅原子和6个氧原子,每个硅原子与4个氧原子成键,每个氧原子与2个硅原子成键.
(3).共价键强弱和原子晶体熔沸点大小的判断:原子半径越小,形成共价键的键长越短,共价键的键能越大,其晶体熔沸点越高.如熔点:金刚石>碳化硅>晶体硅.
例26.下列说法正确的是(NA为阿伏加德罗常数)
A.电解CuCl2溶液,阴极析出16g铜时,电极上转移的电子数为NA
 B.12 g石墨中含有C-C键的个数为1.5NA C.12 g金刚石中含有C-C键的个数为4NA
B.12 g石墨中含有C-C键的个数为1.5NA C.12 g金刚石中含有C-C键的个数为4NA
D.SiO2晶体中每摩尔硅原子可与氧原子形成2NA个共价键
例27.单质硼有无定形和晶体两种,参考下表数据
|
|
金刚石 |
晶体硅 |
晶体硼 |
|
熔点 |
>3823 |
1683 |
2573 |
|
沸点 |
5100 |
2628 |
2823 |
|
硬度 |
10 |
7.0 |
9.5 |
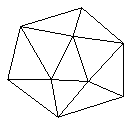 ①晶体硼的晶体类型属于____________晶体,理由是________________________.
①晶体硼的晶体类型属于____________晶体,理由是________________________.
②已知晶体硼结构单元是由硼原子组成的正二十面体,其中有20个等边三角形的面和一定数目的顶点,每个项点上各有1个B原子.通过观察图形及推算,此晶体体结构单元由____个B原子组成,键角_________.
例27.①.原子,理由:晶体的熔、沸点和硬度都介于晶体Si和金刚石之间,而金刚石和晶体Si均为原予晶体,B与C相邻与Si处于对角线处,亦为原于晶体.
②.每个三角形的顶点被5个三角形所共有,所以,此顶点完全属于一个三角形的只占到1/5,每个三角形中有3个这样的点,且晶体B中有20个这样的角形,因此,晶体B中这样的顶点(B原子)有3/5×20=12个.又因晶体B中的三角形面为正三角形,所以键角为60°
4.分子的空间立体结构(记住)
常见分子的类型与形状比较
|
分子类型 |
分子形状 |
键角 |
键的极性 |
分子极性 |
代表物 |
|
A |
球形 |
|
|
非极性 |
He、Ne |
|
A2 |
直线形 |
|
非极性 |
非极性 |
H2、O2 |
|
AB |
直线形 |
|
极性 |
极性 |
HCl、NO |
|
ABA |
直线形 |
180° |
极性 |
非极性 |
CO2、CS2 |
|
ABA |
V形 |
≠180° |
极性 |
极性 |
H2O、SO2 |
|
A4 |
正四面体形 |
60° |
非极性 |
非极性 |
P4 |
|
AB3 |
平面三角形 |
120° |
极性 |
非极性 |
BF3、SO3 |
|
AB3 |
三角锥形 |
≠120° |
极性 |
极性 |
NH3、NCl3 |
|
AB4 |
正四面体形 |
109°28′ |
极性 |
非极性 |
CH4、CCl4 |
|
AB3C |
四面体形 |
≠109°28′ |
极性 |
极性 |
CH3Cl、CHCl3 |
|
AB2C2 |
四面体形 |
≠109°28′ |
极性 |
极性 |
CH2Cl2 |
 |
 |
 |
 |
 |
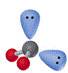 |
|
直 线 |
三角形 |
V形 |
四面体 |
三角锥 |
V形 H2O |
3.了解极性键和非极性键,了解极性分子和非极性分子及其性质的差异.
(1)共价键:原子间通过共用电子对形成的化学键.
(2)键的极性:
极性键:不同种原子之间形成的共价键,成键原子吸引电子的能力不同,共用电子对发生偏移.
非极性键:同种原子之间形成的共价键,成键原子吸引电子的能力相同,共用电子对不发生偏移.
(3)分子的极性:
①极性分子:正电荷中心和负电荷中心不相重合的分子.
非极性分子:正电荷中心和负电荷中心相重合的分子.
②分子极性的判断:分子的极性由共价键的极性及分子的空间构型两个方面共同决定.
非极性分子和极性分子的比较
|
|
非极性分子 |
极性分子 |
|
形成原因 |
整个分子的电荷分布均匀,对称 |
整个分子的电荷分布不均匀、不对称 |
|
存在的共价键 |
非极性键或极性键 |
极性键 |
|
分子内原子排列 |
对称 |
不对称 |
举例说明:
|
分子 |
共价键的极性 |
分子中正负 电荷中心 |
结论 |
举例 |
|
同核双原子分子 |
非极性键 |
重合 |
非极性分子 |
H2、N2、O2 |
|
异核双原子分子 |
极性键 |
不重合 |
极性分子 |
CO、HF、HCl |
|
异核多原子分子 |
分子中各键的向量和为零 |
重合 |
非极性分子 |
CO2、BF3、CH4 |
|
分子中各键的向量和不为零 |
不重合 |
极性分子 |
H2O、NH3、CH3Cl |
 ③相似相溶原理:极性分子易溶于极性分子溶剂中(如HCl易溶于水中),非极性分子易溶于非极性分子溶剂中(如CO2易溶于CS2中).
③相似相溶原理:极性分子易溶于极性分子溶剂中(如HCl易溶于水中),非极性分子易溶于非极性分子溶剂中(如CO2易溶于CS2中).
例20.根据科学人员探测:在海洋深处的沉积物中含有可燃冰,主要成分是甲烷水合物.其组成的两种分子的下列说法正确的是
A.它们都是极性键形成的极性分子 B.它们都只有σ键
C.它们成键电子的原子轨道都是sp3-s D.它们的立体结构都相同
2.了解共价键的主要类型σ键和π键,能用键能、键长、键角等数据说明简单分子的某些性质(对σ键和π键之间相对强弱的比较不作要求).
(1).共价键的分类和判断:σ键(“头碰头”重叠)和π键(“肩碰肩”重叠)、极性键和非极性键,还有一类特殊的共价键-配位键.
(2).共价键三参数.
|
|
概念 |
对分子的影响 |
|
键能 |
拆开1mol共价键所吸收的能量(单位:kJ/mol) |
键能越大,键越牢固,分子越稳定 |
|
键长 |
成键的两个原子核间的平均距离(单位:10-10米) |
键越短,键能越大,键越牢固,分子越稳定 |
|
键角 |
分子中相邻键之间的夹角(单位:度) |
键角决定了分子的空间构型 |
共价键的键能与化学反应热的关系:反应热= 所有反应物键能总和-所有生成物键能总和.
例18.下列分子既不存在s-p σ键,也不存在p-p π键的是
 A.HCl B.HF
C.SO2 D.SCl2
A.HCl B.HF
C.SO2 D.SCl2
例19.下列关于丙烯(CH3-CH =CH2)的说法正确的
A.丙烯分子有8个σ键,1个π键 B.丙烯分子中3个碳原子都是sp3杂化
C.丙烯分子存在非极性键 D.丙烯分子中3个碳原子在同一直线上
内容:离子键――离子晶体
1.理解离子键的含义,能说明离子键的形成.了解NaCl型和CsCl型离子晶体的结构特征,能用晶格能解释离子化合物的物理性质.
(1).化学键:相邻原子之间强烈的相互作用.化学键包括离子键、共价键和金属键.
(2).离子键:阴、阳离子通过静电作用形成的化学键.
离子键强弱的判断:离子半径越小,离子所带电荷越多,离子键越强,离子晶体的熔沸点越高.
离子键的强弱可以用晶格能的大小来衡量,晶格能是指拆开1mol离子晶体使之形成气态阴离子和阳离子所吸收的能量.晶格能越大,离子晶体的熔点越高、硬度越大.
离子晶体:通过离子键作用形成的晶体.
典型的离子晶体结构:NaCl型和CsCl型.氯化钠晶体中,每个钠离子周围有6个氯离子,每个氯离子周围有6个钠离子,每个氯化钠晶胞中含有4个钠离子和4个氯离子;氯化铯晶体中,每个铯离子周围有8个氯离子,每个氯离子周围有8个铯离子,每个氯化铯晶胞中含有1个铯离子和1个氯离子.
|
NaCl型晶体 |
CsCl型晶体 |
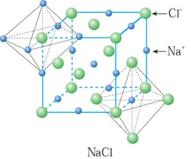 每个Na+离子周围被6个C1-离子所包围,同样每个C1-也被6个Na+所包围。 |
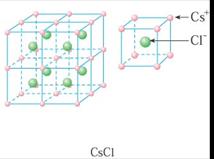 每个正离子被8个负离子包围着,同时每个负离子也被8个正离子所包围。 |
 (3).晶胞中粒子数的计算方法--均摊法.
(3).晶胞中粒子数的计算方法--均摊法.
|
位置 |
顶点 |
棱边 |
面心 |
体心 |
|
贡献 |
1/8 |
1/4 |
1/2 |
1 |
例14.下列离子晶体中,熔点最低的是
A.NaCl B.KCl C.CaO D.MgO
例15.X、Y都是IIA(Be除外)的元素,已知它们的碳酸盐的热分解温度:T(XCO3)>T(YCO3),则下列判断正确的是
A.晶格能: XCO3>YCO3 B.阳离子半径: X2+>Y2+
C.金属性: X>Y D.氧化物的熔点: XO>YO
例16.萤石(CaF2)晶体属于立方晶系,萤石中每个Ca2+被8个F-所包围,则每个F-周围最近距离的Ca2+数目为
A.2 B.4 C.6 D.8
例17.01年曾报道,硼元素和镁元素形成的化合物刷新了金属化合物超导温度的最高记录.该化合物的晶体结构如图所示:镁原子间形成正六棱柱,且棱柱的上下底面还各有1个镁原子;6个硼原子位于棱柱内,则该化合物的化学式可表示为
A.MgB B.MgB2 C.Mg2B D.Mg3B2

○镁原子,位于顶点和上下两个面心
●硼原子,位于六棱柱的内部
内容:共价键-分子晶体――原子晶体
4.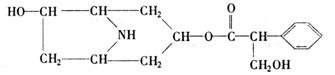 [2008珠海一模]某有机化合物A的结构简式如下:
[2008珠海一模]某有机化合物A的结构简式如下:
(1)A分子式是 。
(2)A在NaOH水溶液中加热反应得到B和C,C是芳香化合物。B和C的结构简式是
B: C:
该反应属于 反应。
(3)室温下,C用稀盐酸酸化得到E,E的结构简式是
(4)在下列物质中,不能与E发生化学反应的是(填写序号) 。
① 浓H2SO4和浓HNO3的混合液 ②CH3CH2OH(酸催化) ③CH3CH2CH2CH3 ④Na
⑤ CH3COOH(酸催化)
(5)写出同时符合下列两项要求的E的同分异构体的结构简式(写出其中的两种)。
①化合物是1,3,5-三取代苯
②苯环上的三个取代基分别为甲基、羟基和含有?C=O?结构的基团。
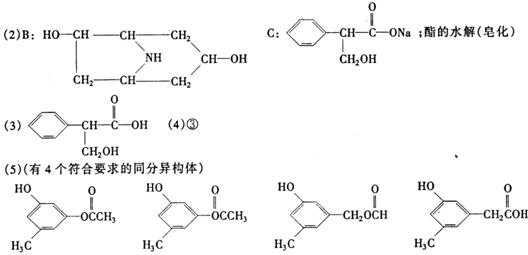 (1)C16H2l04N
(1)C16H2l04N
 第五讲
第五讲
3.[2008珠海一模]“C1化学”是指以分子中只含一个碳原子的物质为原料进行物质合成的化学。下图是以天然气的主要成分为原料的合成路线流程图,其中“混合气体”的成分与水煤气相同;B的水溶液有杀菌防腐性能;D是C的钠盐,2mol D分子间脱去1mol H2分子可缩合生成E;H是F与A按物质的量之比为1∶2反应的产物。
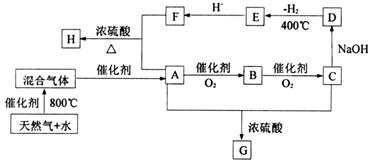
 填写下列空白:
填写下列空白:
(1)天然气主要成分的电子式是 ;E的化学式是 。
(2)D、G的结构简式是D G 。
(3)写出下列反应式的化学方程:
A→B
A+F→H 。
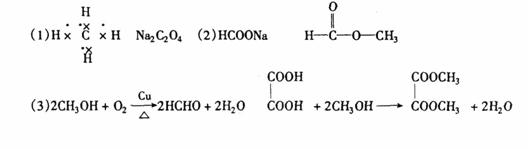
1.[2008珠海一模]已知A、B、C、D和E五种分子所含原子的数目依次为1、2、3、4和6,且都含有18个电子,又知B、C和D是由两种元素的原子组成,且D分子中两种原子个数比为1:1。
请回答:
(1) 组成A分子的原子的核外电子排布式是 ;
(2) B和C的分子式分别是 和 ;C分子的立体结构呈 形,该分子属于 分子(填“极性”或“非极性”);
(3) 向D的稀溶液中加入少量氯化铁溶液现象是 ,该反应的化学方程式为
(4) 若将1molE在氧气中完全燃烧,只生成1molCO2和2molH2O,则E的分子式是 。
|
(3)有无色气体产生 2H2O2===2H2O+O2↑ (4)CH4O。
2 [2008茂名一模]Al和Si、Ge和As在元素周期表金属和非金属过渡位置上,在其单质和化合物在建筑业、电子工业和石油化工等方面应用广泛。请回答下列问题:
 (1) As 的价层电子构型为
(1) As 的价层电子构型为
(2) AlCl3是化工生产中的常用催化剂,熔点为192.6℃,熔融状态以二聚体A12C16形式存在,其中铝原子与氯原子的成键类型是
(3)超高导热绝缘耐高温纳米氮化铝(AlN)在绝缘材料中的应用广泛,AlN晶体与金刚石类似,每个Al原子与个N原子相连,与同一个Al原子相连的N原子构成的空间构型为。在四大晶体类型中,AlN属于 晶体。
(4)Si和C 同主族,Si、C和0成键情况如下:
在C和0之间可以形成双键形成CO2分子,而Si和O则不能和碳那样形成有限分子原因是
(5)SiCl4(l)常用作烟雾剂,原因Si存在3d轨道,能同H20 (l)配位而剧烈水解,在潮湿的空气中发烟,试用化学方程式表示其原理
(l) 4s24p3( l 分) (2)共价键(或σ键) (l分)
(3) 4 (l分)正四面体(l分)原子(2分) (4) Si一0大于C一0的键,C=0的键能大于Si=O的键能,所以Si和O成单键,而C和O以双键形成稳定分子( 2 分)
(5)SiCl4(l) + 3H2O (l) = H2Si03 (s) + 4HCl(aq) ( 2 分)
选修有机化学5
3.元素电离能和元素电负性
第一电离能:气态电中性基态原子失去1个电子,转化为气态基态正离子所需要的能量叫做第一电离能。常用符号I1表示,单位为kJ/mol。
(1).原子核外电子排布的周期性.
 随着原子序数的增加,元素原子的外围电子排布呈现周期性的变化:每隔一定数目的元素,元素原子的外围电子排布重复出现从ns1到ns2np6的周期性变化.
随着原子序数的增加,元素原子的外围电子排布呈现周期性的变化:每隔一定数目的元素,元素原子的外围电子排布重复出现从ns1到ns2np6的周期性变化.
(2).元素第一电离能的周期性变化.
随着原子序数的递增,元素的第一电离能呈周期性变化:
★同周期从左到右,第一电离能有逐渐增大的趋势,稀有气体的第一电离能最大,碱金属的第一电离能最小;
★同主族从上到下,第一电离能有逐渐减小的趋势.
说明:
①同周期元素,从左往右第一电离能呈增大趋势。电子亚层结构为全满、半满时较相邻元素要大即第 ⅡA 族、第 ⅤA 族元素的第一电离能分别大于同周期相邻元素。Be、N、Mg、P
②.元素第一电离能的运用:
a.电离能是原子核外电子分层排布的实验验证.
b.用来比较元素的金属性的强弱. I1越小,金属性越强,表征原子失电子能力强弱.
(3).元素电负性的周期性变化.
元素的电负性:元素的原子在分子中吸引电子对的能力叫做该元素的电负性。
随着原子序数的递增,元素的电负性呈周期性变化:同周期从左到右,主族元素电负性逐渐增大;同一主族从上到下,元素电负性呈现减小的趋势.
电负性的运用:
a.确定元素类型(一般>1.8,非金属元素;<1.8,金属元素).
b.确定化学键类型(两元素电负性差值>1.7,离子键;<1.7,共价键).
c.判断元素价态正负(电负性大的为负价,小的为正价).
d.电负性是判断金属性和非金属性强弱的重要参数(表征原子得电子能力强弱).
例8.下列各组元素,按原子半径依次减小,元素第一电离能逐渐升高的顺序排列的是
A.K、Na、Li B.N、O、C C.Cl、S、P D.Al、Mg、Na
例9.已知X、Y元素同周期,且电负性X>Y,下列说法错误的是
A.X与Y形成化合物时,X显负价,Y显正价
B.第一电离能可能Y小于X
 C.最高价含氧酸的酸性:X对应的酸性弱于Y对应的酸性
C.最高价含氧酸的酸性:X对应的酸性弱于Y对应的酸性
D.气态氢化物的稳定性:HmY小于HmX
例10.气态中性原子失去一个电子转化为气态正离子所需要的最低能量叫做第一电离能(I1),气态正离子继续失去电子所需最低能量依次称为第二电离能(I2)、第三电离能(I3)……下表是第三周期部分元素的电离能[单位:eV(电子伏特)]数据.
|
元素 |
I1/eV |
I2/eV |
I3/eV |
|
甲 |
5.7 |
47.4 |
71.8 |
|
乙 |
7.7 |
15.1 |
80.3 |
|
丙 |
13.0 |
23.9 |
40.0 |
|
丁 |
15.7 |
27.6 |
40.7 |
下列说法正确的是
A.甲的金属性比乙强 B.乙的化合价为+1价
C.丙一定为非金属元素 D.丁一定是金属元素
例11.在下面的电子结构中,第一电离能最小的原子可能是
A.ns2np3 B.ns2np5 C.ns2np4 D.ns2np6
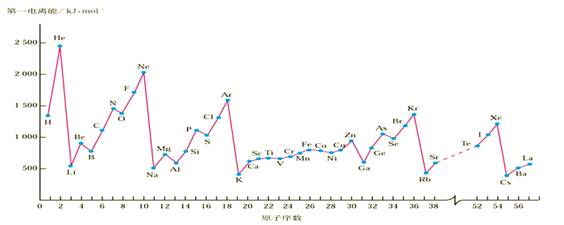
例12.第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的能量.下图是部分元素原子的第一电离能I1随原子序数变化的曲线图.
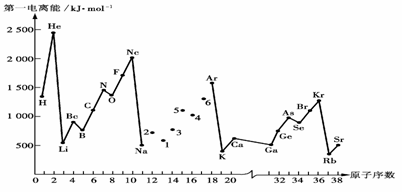
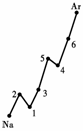
请回答以下问题:
(1).认真分析上图中同周期元素第一电离能的变化规律,将Na--Ar之间六种元素用短线连接起来,构成完整的图像.
(2).从上图分析可知,同一主族元素原子的第一电离能I1变化规律是______________;
(3).上图中5号元素在周期表中的位置是________________________________________;
 (4).上图中4、5、6三种元素的气态氢化物的沸点均比同主族上一周期的元素气态氢化物低很多,原因是:__________________________________.
(4).上图中4、5、6三种元素的气态氢化物的沸点均比同主族上一周期的元素气态氢化物低很多,原因是:__________________________________.
例12.(1).见上图(右) (2).从上到下依次减小
 (3).第三周期,ⅤA族
(3).第三周期,ⅤA族
(4).因同主族上一周期的元素的氢化物分子间存在氢键
例13.1932年美国化学家鲍林首先提出了电负性的概念.电负性(用X表示)也是元素的一种重要性质,若 x 越大,其原子吸引电子的能力越强,在所形成的分子中成为带负电荷的一方.下面是某些短周期元素的 x 值:
|
元素符号 |
Li |
Be |
B |
C |
O |
F |
Na |
Al |
Si |
P |
S |
Cl |
|
x 值 |
0.98 |
1.57 |
2.04 |
2.55 |
3.44 |
3.98 |
0.93 |
1.61 |
1.90 |
2.19 |
2.58 |
3.16 |
⑴.通过分析 x 值变化规律,确定N、Mg的 x 值范围:
<x (N)< , <x (Mg)< .
⑵.推测x值与原子半径的关系是 ;根据短周期元素的x值变化特点,体现了元素性质的 变化规律.
⑶.某有机化合物结构中含S-N键,其共用电子对偏向 (写原子名称).
⑷.经验规律告诉我们:当成键的两原子相应元素的 x 差值△x>1.7时,一般为离子键,当△ x<1.7时,一般为共价键.试推断AlBr3中化学键类型是 .
⑸.预测周期表中, x 值最小的元素位于 周期 族.(放射性元素除外)
例13.(1).2.55 3.44 0.93 1.57
(2).电负性随原子半径减小而增大,周期性
(3).氮 (4).共价键 (5).6,IA
『综合模拟训练』
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com