
19.现有部分短周期元素的性质或原子结构如下表:
|
元素编号 |
元素性质或原子结构 |
|
T |
能形成双原子分子,原子间存在3对共用电子对 |
|
X |
M层有3个电子 |
|
Y |
最外层电子数是最内层电子数2倍,其最高价氧化物是一种固体,用于生产光导纤维 |
|
Z |
 最低负价为-2价,且无最高正价 最低负价为-2价,且无最高正价 |
用化学符号回答以下问题:
(1) 比较:氢化物的稳定性:T Z,最高价氧化物对应水化物的酸性:T Y。(填“>”、“<”或“=”)
(2) 写出T的氢化物的电子式: 。
(3) X的最高价氧化物对应水化物与烧碱反应的离子方程式为: 。
(4) T、X、Y、Z四种原子的半径由大到小的顺序为: 。
(5) 汽车内燃机工作时产生的高温会引起T2和Z2的反应,是导致汽车尾气中含有TZ的原因之一。汽车尾气中还含有CO气体。为避免汽车尾气中的有害气体对大气的污染,给汽车安装尾气净化装置,使尾气中的有害气体成分在催化剂作用下转化为无害气体排出,参与大气循环。写出此反应的化学方程式: 。
18.从根本上解决环境和生态问题,还要依靠绿色化学的发展。温室效应是全球关注的环境问题之一。CO2 是目前大气中含量最高的一种温室气体。最近日本承诺将逐步减少CO2 的排放量。
(1)下列措施中,有利于降低大气中CO2 浓度的有: (填字母)。
a. 减少化石燃料的使用 b. 降低人口出生率
c. 采用节能技术 d. 利用太阳能、风能
(2)绿色化学提倡化工生产应提高原子利用率,原子利用率表示目标产物的质量与生成物的总质量之比。将CO2 转化为有机物可有效实现碳循环。CO2 转化成有机物的例子很多,如:
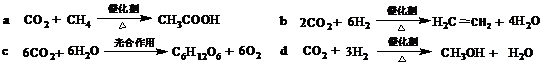
以上反应中,最节能的是 ,原子利用率最高的是 。
17.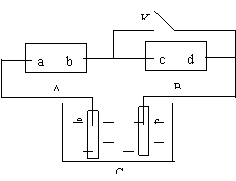 右图A为直流电源,B为渗透饱和氯化钠溶 液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B 上的 C 点显红色,请填空:
右图A为直流电源,B为渗透饱和氯化钠溶 液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B 上的 C 点显红色,请填空:
(1)电源A的a为 极。
(2)滤纸B上发生的总反应方程式为:
。
(3)欲在电镀槽中实现铁上镀锌,接通K点,使c、d两点短路,则电极e上发生的反应为: ,电极f上发生的反应为: _______________________。
16. A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族,D的最高价氧化物的水化物的酸性在同周期为最强,且B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水。F元素的一种同位素的中子数为0 。
A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族,D的最高价氧化物的水化物的酸性在同周期为最强,且B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水。F元素的一种同位素的中子数为0 。
根据以上信息,回答下列问题:
(1)A和D气态氢化物中,稳定性高的是 (选填“A”或“D”)
(2)元素C在元素周期表中的位置是 。
(3)写出C的最高价氧化物的水化物分别与B、D的最高价氧化物的水化物反应的离子方程式 、 。
15.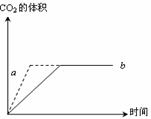 在利用CaCO3与盐酸反应制取二氧化碳的反应中,反应中生成二 氧化碳的体积与反应时间的关系如图所示,两个实验所用的盐酸浓度相同,其中一个实验用是石灰石块,另一实验用是石灰石粉末,则从图中可以看出:
在利用CaCO3与盐酸反应制取二氧化碳的反应中,反应中生成二 氧化碳的体积与反应时间的关系如图所示,两个实验所用的盐酸浓度相同,其中一个实验用是石灰石块,另一实验用是石灰石粉末,则从图中可以看出:
①使用石灰石块的是 (填a或b,下同),反应速率 较快的曲线是 ,由b图变为a的原因是
②如果实验过程中所用的盐酸是过量的,则所取块状石灰石与粉末状石灰石的质量是否相等? (填“相等”或“不相等”)。在此条件下,如果一个反应(石灰石块)是在25℃时进行,而另一个反应(石灰石粉末)是在30℃时进行,则在25℃时进行的反应曲线是________(填a或b或不能确定)
14. 以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。关于该电池的叙述正确的是:
 A.该电池能够在高温下工作
A.该电池能够在高温下工作
B.电池的负极反应为:C6H12O6+6H2O-24e-=6CO2+24H+
C.放电过程中,H+从正极区向负极区迁移
D.在电池反应中,每消耗1mol氧气,理论上能生成标准状况下
CO2 22.4/6 L
13.下列除去杂质的方法正确的是
A. 除去乙烷中的少量乙烯:通入过量的氢气
B. 除去Na2CO3固体中的少量NaHCO3:加热
C. 除去FeCl3溶液中的少量FeCl2:加入足量铁屑,充分反应后,过滤
 D. 除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤得溶液
D. 除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤得溶液
12. X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是:
A.元素Y、Z、W具有相同电子层的离子,其半径依次增大
B.元素X不能与元素Y形成化合物X2Y2
 C.元素Y、R分别与元素X形成的化合物的热稳定性:XmY> XmR
C.元素Y、R分别与元素X形成的化合物的热稳定性:XmY> XmR
D.元素W、R的最高价氧化物的水化物都是强酸
11. 一定温度下,在一容积不变的密闭容器中发生的可逆反应2X(g)  Y(g)+Z(s),
Y(g)+Z(s),
以下能说明作为反应达到平衡的标志是
A.X的分解速率与Y的消耗速率相等
B.反应容器中压强不再变化
C.混合气体的密度不再变化
D.单位时间内生成lmolY的同时分解2mol X
10.氢气虽然是一种理想的绿色能源,但目前仍处在研究、试验阶段,还未得到广泛应用,其原因可能是
A.氢气虽可由水制备获得,但水资源严重匮乏
B.氢气制备耗能巨大,廉价制氢技术尚未成熟
C.氢气贮存、运输等安全技术尚未很好的解决
D.氢气燃烧产物虽无污染,但其放出热量较少
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com