
5. 某饮料的主要成分为:脂肪、蛋白粉、钾、钙等。该饮料不能为人体补充的营养素是
A.无机盐 B.维生素 C.蛋白质 D. 油脂
4. 把少量下列物质放入水中,能形成溶液的是
A.小苏打 B.汽油 C.石灰石 D.面粉
3. 下列物质中,属于纯净物的是
A.澄清的石灰水 B.新鲜的空气 C.不锈钢 D.干冰
2.由于森林的过量砍伐、草场大面积开垦,土地出现沙漠化,导致我市今年出现了近几年来最严重的沙尘暴天气。沙尘暴天气使空气中增加了大量的
A.可吸入颗粒物 B.一氧化碳 C.二氧化氮 D.二氧化硫
1. 下列家庭实验中不涉及化学变化的是
A.用少量食醋除去水壶中的水垢 B.用糯米、酒曲和水制甜酒酿
C.用75%的酒精杀菌消毒 D.用木炭除去冰箱中的异味
|
(1)上述化学反应方程式中“ ”内对应产物的化学式为 。
(2)铜元素在化学反应前后化合价变化情况是:从 价变到 价。
(3)甲烷中碳元素的质量分数为 (填计算结果)。
28.(7分)烧杯中装有一定量硫酸和硫酸铜的混合溶液,已知该溶液中含H2SO4的质量为9.8g。某同学为测定该混合溶液中硫酸铜的质量,向烧杯中逐渐加入10%的NaOH溶液,得到沉淀的质量记录如下:
|
加入NaOH溶液的质量/g |
50.0 |
100.0 |
150.0 |
200.0 |
250.0 |
|
生成沉淀的质量/g |
0.0 |
2.5 |
8.6 |
9.8 |
9.8 |
(1)得到沉淀的总质量为 g,该混合溶液中硫酸铜的质量为 g。
(2)参加反应的NaOH溶液的总质量是多少克?(要求写出计算过程)
(3)画出在该混合溶液中加入NaOH溶液质量与生成沉淀质量变化关系的曲线(见答题卡)。
佛山市2009年高中阶段学校招生考试
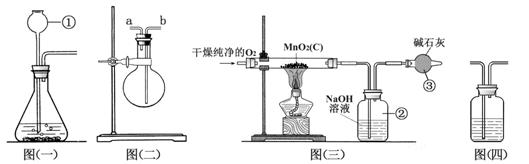 25.(10分)某二氧化锰样品中含有杂质炭,为测定该样品中二氧化锰的质量分数,某兴趣小组设计了如下实验方案:在一定量的样品中通入干燥纯净的氧气,使杂质炭在加热条件下反应生成CO2来进行分析测定。
25.(10分)某二氧化锰样品中含有杂质炭,为测定该样品中二氧化锰的质量分数,某兴趣小组设计了如下实验方案:在一定量的样品中通入干燥纯净的氧气,使杂质炭在加热条件下反应生成CO2来进行分析测定。
(1)仪器①的名称是 。如果该实验选择图㈠装置来制取氧气,则所用药品为 (填化学式),反应的化学方程式为 。
(2)用图㈡装置可收集和干燥氧气:若烧瓶充满水来收集氧气,气体应从 (填“a”或“b”,下同)端通入;若在烧瓶内装入浓硫酸进行干燥气体,气体应从 端通入。
(3)图㈢是用干燥纯净的O2与样品反应来测定二氧化锰质量分数的装置,装置③中装有碱石灰,其作用是____________________________________________________。
(4)为验证图㈢中装置②已将CO2吸收完全,可在装置②与③之间加入图㈣装置进行证明,则图㈣装置中加入的试剂为__________(填字母)。
A. NaOH溶液 B. 澄清石灰水 C. 浓硫酸
(5)称取5.0 g二氧化锰样品进行实验,图㈢中装置②反应前后的质量差为1.1 g,则样品中二氧化锰的质量分数为____________(填计算结果)。
26.(7分)已知某合金粉末除铝外,还含有铁、铜中的一种或两种。某兴趣小组在老师的指导下,对合金粉末中铁、铜的存在情况进行了探究。
[查阅资料]铝与氢氧化钠溶液反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑( 产物NaAlO2溶于水);Fe、Cu不与氢氧化钠溶液反应。
[猜 想]猜想1:该合金粉末中除铝外,还含有铁。
猜想2:该合金粉末中除铝外,还含有 (填名称)。
猜想3:该合金粉末中除铝外,还含有铁、铜。
[实验探究]下列实验仅供选择的试剂:10%盐酸、30%NaOH溶液。
|
实验方案 |
实现现象 |
结论 |
|
①取一定量的合金粉末,加过量的 ,充分反应后过滤,滤渣备用。 |
粉末部分溶解,并有气体放出。 |
合金中一定含有 。 |
|
②取步骤①所得滤渣,加过量的 ,充分反应。 |
滤渣部分溶解,并有气体放出,溶液呈浅绿色。 |
合金中一定含有 。 |
[探究结论]猜想3成立。
[反思]一般来说,活泼金属能与盐酸等酸反应,而铝与酸、碱都能反应,说明铝具有特殊的性质。写出铝与稀盐酸反应的化学方程式 。
23.(5分)在研究“铁生锈的条件”的实验中,某兴趣小组对实验进行了创新设计,请把实验报告补充完整。
[实验目的]铁生锈条件的探究。
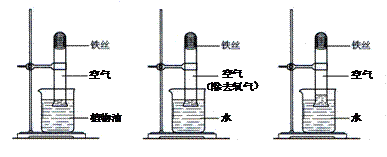 [实验内容]取3段光亮无锈的细铁丝,绕成螺旋状,放入3支干燥洁净的试管底部,进行下列实验,实验要保证有足够长的时间来观察现象。
[实验内容]取3段光亮无锈的细铁丝,绕成螺旋状,放入3支干燥洁净的试管底部,进行下列实验,实验要保证有足够长的时间来观察现象。
实验① 实验② 实验③
[实验现象]实验①②无明显现象,实验③中铁丝生锈,且试管内空气体积减小。
[实验结论]铁生锈实际上是铁与空气中的 (填名称)发生反应的结果。
[实验思考]
(1)当铁丝足量,时间足够长,实验③进入试管内的水的体积约占试管体积的 。
(2)该实验创新之处在于:可根据铁丝表面的铁锈和 两种现象来判断铁丝反应进行的情况。
(3)用完的菜刀要擦干存放,理由是 。
(4)铝比铁活泼,但铝难腐蚀,原因是 。
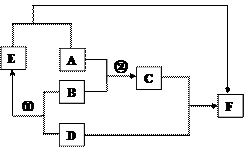 24.(6分)A、D均为黑色固体(D为常见金属),
24.(6分)A、D均为黑色固体(D为常见金属),
B为胃酸的主要成分,C为蓝色溶液,D、E、F均
为单质。右图为这些物质的转化关系,其中部分反
应物、生成物、反应条件已省略。
(1)请写出下列物质的化学式:
E ,F 。
(2)反应①除了生成E,另一生成物的化学式
为 ,该反应的基本类型是 。
(3)写出反应②的化学方程式 。
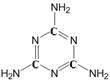
21.(5分)三聚氰胺的化学式为C3H6N6(结构见右图),是一种用途
广泛的有机化工原料。该物质为纯白色晶体,无味,溶于热水,微溶
于冷水。一般情况下较稳定,但在高温下能分解放出氰化物。
(1)三聚氰胺的相对分子质量为 ,化学性质有 (写一条)。
(2)根据三聚氰胺的组成和结构进行分析,下列有关有机物的认识错误的是
(填字母)。
A.有机物都含有碳元素
B.有机物还可能含有氢、氮等元素
C.有机物中碳原子可以跟氢、氮等原子直接结合
D.有机物的相对分子质量都很大,都属于有机高分子
(3)通常可用尿素[CO(NH2)2]在一定条件下反应生成三聚氰胺,同时放出氨气和二氧化碳气体,请写出反应的化学方程式 。
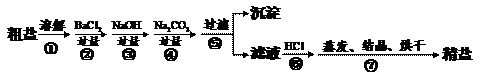 22.(5分)通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是制备精盐的实验方案,各步操作流程如下:
22.(5分)通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是制备精盐的实验方案,各步操作流程如下:
(1)在第①步粗盐溶解操作中要用玻璃棒搅拌,作用是 。
(2)第②步操作的目的是除去粗盐中的 (填化学式,下同),第⑥步操作的目的是除去滤液中 。
(3)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、
(填化学式)。
(4)在第③步操作中,选择的除杂的试剂不能用KOH代替NaOH,理由是
。
20.(3分)下表是3种物质在不同温度时的溶解度,根据表格信息答题。
|
温度/℃ |
0 |
20 |
40 |
60 |
80 |
100 |
|
|
溶解度/g |
NaCl |
35.7 |
36.0 |
36.6 |
37.3 |
38.4 |
39.8 |
|
KNO3 |
13.3 |
31.6 |
63.9 |
110 |
169 |
246 |
|
|
Ca(OH)2 |
0.18 |
0.16 |
0.14 |
0.12 |
0.09 |
0.07 |
(1)某饱和溶液随温度升高有固体析出,则该饱和溶液的溶质是 (填化学式)。
(2)要配制20℃时的NaCl饱和溶液100g,需要NaCl的质量为 g(保留小数点后一位)。
(3)某KNO3晶体中有少量NaCl、Ca(OH)2杂质,要得到纯净KNO3的方法是:先加热溶解,然后 ,过滤、洗涤、干燥后得到KNO3晶体。
 三、(本题包括4小题,共21分)
三、(本题包括4小题,共21分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com