
6.用下图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U形管的质量差.李松同学通过实验得出的结论是m(H)∶m(O)>1∶8.下列对导致这一结果原因的分析中,一定不合理的是 ( )

A.Ⅰ、Ⅱ装置之间缺少干燥装置
B.Ⅲ装置后缺少干燥装置
C.Ⅱ装置中的CuO粉末可能不干燥
D.CuO没有全部被还原
5.配制一定物质的量浓度溶液时,会导致所配溶液浓度偏大的操作是 ( )
A.在用蒸馏水洗涤烧杯时,洗液未全部注入容量瓶中
B.定容摇匀后,发现液面低于刻度线,又加水到刻度
C.定容时俯视刻度线
D.用来配制溶液的容量瓶用蒸馏水洗涤后未进行干燥处理
4.在某一澄清、透明的浅黄色溶液中,可能含有下列八种离子:H+、NH、Fe3+、Ba2+、
Al3+、SO、HCO、I-,在检验方案设计时初步分析其溶液中最多可含离子(不包括OH-)有 ( )
A.4种 B.5种 C.6种 D.7种
3.下列实验设计和结论相符的是 ( )
A.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
B.某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性
C.某无色溶液中加Ba(NO3)2溶液,再加稀盐酸,沉淀不溶解,则原溶液中一定有SO
D.在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净的FeCl3溶液
2.NA代表阿伏加德罗常数.下列有关叙述正确的是 ( )
A.标准状况下,2.24 L H2O含有的分子数等于0.1NA
B.常温下,100 mL 1 mol/L Na2CO3溶液中阴离子总数大于0.1 NA
C.分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g
D.3.4 g NH3中含N-H键数目为0.2 NA
1.下列关于Fe(OH)3胶体的说法不正确的是 ( )
A.Fe(OH)3溶胶与硅酸溶胶混合将产生凝聚现象
B.Fe(OH)3胶体在电场作用下;向阳极运动
C.Fe(OH)3胶体微粒不停地作布朗运动
D.光线通过Fe(OH)3溶胶时会发生丁达尔现象
1.在如图所示电路中,电阻R1=20欧,R2=30欧,R3=60欧,则电阻R1与R3两端电圧之比U1 : U3= ;通过电阻R1与R3电流I1 : I3 = 。
3.串、并联电路的性质
(1)串联电路
电流关系: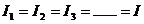
电压关系: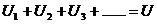
电阻关系: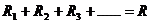
(2)并联电路
电流关系: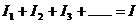
电压关系: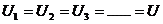
电阻关系: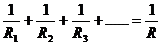
附录
2. 电流的形成
电流的形成:自由电荷在外加电场作用下的定向移动形成电流
电流的方向:正电荷定向移动的方向
第八章 电路
A 简单串联、并联组合电路
1.基本概念及欧姆定律
电流(I):单位时间内通过导体横截面的电荷量,即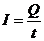
电压(U):使自由电荷发生定向移动形成电流的原因
电阻(R):导体对电流的阻碍作用。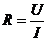
电流与电阻、电压的关系:欧姆定律,即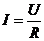
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com