
25.(10分)从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取两种工艺品的流程如下:
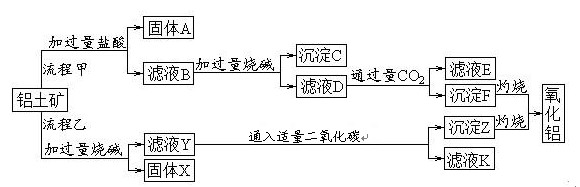
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的方程式为_________.
(2)验证滤液B含Fe3+,可取少量滤液并加入________(填试剂名称)。
(3)滤液E中溶质的主要成份是_____(填化学式),写出该溶液的一种用途________
(4)已知298K时,Mg(OH)2的容度积常数Ksp=5.6×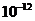 ,取适量的滤液B,加入一定量的烧碱达到沉淀溶液平衡,测得pH=13.00,则此温度下残留在溶液中的c(Mg2+)=______。
,取适量的滤液B,加入一定量的烧碱达到沉淀溶液平衡,测得pH=13.00,则此温度下残留在溶液中的c(Mg2+)=______。
24.(8分)某溶液仅含下表离子中的5种(不考虑水的电离及离子的水解)且各种离子物质的量均为1mol。
|
阳离子 |
Na+ Mg2+ Fe3+ Al3+ Fe2+ |
|
阴离子 |
OH-
CO32-
Cl- NO3- SO42- |
①若向溶液中加入KSCN溶液无明显变化;
②若向原溶液中加入稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,且溶液中阴离子种类不变;请推断:
(1)原溶液中含有阳离子: ;含有阴离子: ;
(2)向原溶液中加入足量稀盐酸发生反应的离子方程式: ;
(3)若向原溶液中加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为 g。
23.(14分)由短周期元素组成的A、B、C、D、E、F六种粒子,其中只有C、D是分子,其余四种均是离子,且每个微粒中都含有10个电子。已知A、E是由非金属元素组成的阳离子,六种粒子间有下列关系:
①A、B两种离子在加热条件下可生成C、D两种分子;
②通常状况下C的聚集状态为气态,且可使湿润的红色石蕊试纸变蓝;
③1 mol B离子与1 mol E离子作用可生成2 mol D分子;
④向含F离子的溶液中加入C的溶液,可生成白色沉淀W,C溶液过量沉淀也不消失,若加入含大量B离子或大量E离子的溶液,沉淀W都会溶解。
(1)微粒B的电子式是_____________;粒子E的名称是____________;
(2)粒子F对应的元素在周期表中的位置是_________________________________。
(3)写出下列反应的离子方程式:
F+过量C的溶液:___________________________________________________
W+含大量B离子的溶液:
(4)六种微粒中的两种可与硫酸根形成一种复盐,向该复盐的浓溶液中滴加浓苛性钠溶液,产生的现象有(未排序):①有刺激性气味气体放出 ②沉淀逐渐减少 ③溶液中出现白色沉淀④沉淀完全消失 ⑤沉淀逐渐增多
该复盐的化学式为 ,产生的现象正确的排序是____ _______
22.某溶液中可能存在Br-、CO32-、SO32-、Al3+、I-、Mg2+、Na+等7种离子中的几种。现取该溶液进行实验,得到如下现象:
①向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;
②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。
据此可以推断:该溶液中肯定不存在的离子组是
A.Al3+、Mg2+、I-、SO32- B.Mg2+、Na+、CO32-、I-
C.Al3+、Na+、SO32-、I- D.Al3+、CO32-、Br-、SO32-
21.有Fe2+、NO3-、Fe3+、NH4+、H+和H2O六种粒子,属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是( )
A.氧化剂和还原剂的物质的量之比为1∶8
B.该过程说明Fe(NO3)2溶液不宜加酸酸化
C.每1 mol NO3-发生氧化反应,转移8 mol e-
D.若把该反应设计为原电池,则负极反应为Fe2+-e-=Fe3+
20.配制一定体积、一定物质的量浓度的溶液时,下列操作会使配得的溶液浓度偏小的是
A.容量瓶中原有少量蒸馏水 B.溶液从烧杯转移到容量瓶中后没有洗涤烧杯
C.定容时观察液面俯视 D.滴管加水时,有少量水滴到容量瓶外
19.往含0.2mol KOH和0.1mol Ca(OH)2的溶液中持续地通入CO2气体,当通入气体的体积为6.72L(标准状况)时立即停止,则在这一过程中,溶液中离子的物质的量n和通入CO2的体积V的关系示意图正确的是(气体的溶解和离子的水解忽略)

18.铜和镁的合金4.6g完全溶于浓硝酸,若反应中硝酸被还原只产生4480 mL的NO2气体和336 mL的N2O4气体(气体的体积已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为
A.9.02g B.8.51g C.8.26g D.7.04g
17.下列实验装置、试剂选用或操作正确的是( )

A.除去NO中的NO2 B.铁制品表面镀锌 C.稀释浓硫酸 D.制备少量O2
16.可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极。下列说法正确的是
A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-=4OH-
B.以NaOH溶液为电解液时,负极反应为:Al+3OH--3e=Al(OH)3↓
C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变
D.电池工作时,电子通过外电路从正极流向负极
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com