
5.(2009·北京市海淀区4月)函数f(x)=2x+1的反函数的图象大致是( )

答案:A
解析:由y=2x+1得x+1=log2y,x=log2y-1(y>0),即函数f(x)=2x+1的反函数是f-1(x)=log2x-1(x>0),注意到函数f-1(x)在(0,+∞)上是增函数,结合各选项知,选A.
4.客车从甲地以60 km/h的速度匀速行驶1小时到达乙地,在乙地停留了半小时,然后以80 km/h的速度匀速行驶1小时到达丙地.下列描述客车从甲地出发,经过乙地,最后到达丙地所经过的路程s与时间t之间关系的图象如下图,正确的是( )

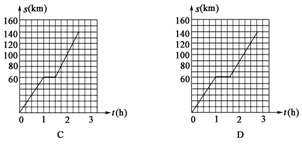
答案:C
解析:图象经过(0,0),(1,60),(1.5,60),(2.5,140)的三段折线,故选C.
3.设f′(x)是函数f(x)的导函数,将y=f(x)和y=f′(x)的图象画在同一个直角坐标系中,如下图中不可能正确的是( )

答案:D
解析:如图A、B、C三个图中C1、C2可分别作为y=f(x)和y=f′(x)的图象,符合题意,对于D,若C1为导函数则y=f(x)应为增函数,不符合,若C2为导函数则y=f(x)应为减函数,也不符合,故选D.
2.函数f(x)=1+log2x与g(x)=2-x+1在同一直角坐标系下的图象大致是如下图中的( )

答案:C
解析:f(x)过点(1,1),g(x)过点(0,2),仅有C符合.故选C.
曲线上的点的坐标,对应其方程的解,因此,找出符合要求的特殊点即可.
1.若函数f(x)的反函数为f-1(x),则函数f(x-1)与f-1(x-1)的图象可能是如下图中的( )

答案:A
解析:y=f(x-1)和y=f-1(x-1)分别是将y=f(x)和y=f-1(x)向右平移1个单位得到,故y=f(x-1)与y=f-1(x-1)关于直线y=x-1对称.故选A.
5.(安徽怀远二中2009届高三上学期第四次月考,化学,21)由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、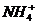 、Mg2+、Ba2+、
、Mg2+、Ba2+、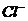 、
、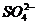 、
、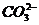 。将该混合物溶于水后得澄清溶液,现取3份100mL该溶液分别进行如下实验:21世纪教育网
。将该混合物溶于水后得澄清溶液,现取3份100mL该溶液分别进行如下实验:21世纪教育网
|
实验序号 |
实验内容 |
实验结果 |
|
1 |
加AgNO3溶液 |
有白色沉淀生成 |
|
2 |
加足量NaOH溶液并加热 |
收集到气体1.12L(已折算成标准 状况下的体积) |
|
3 |
加足量BaC12溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 |
第一次称量读数为6. 27g,第二次 称量读数为2.33g |
试回答下列问题:
(1)根据实验1对C1-是否存在的判断是 (填“一定存在”、“一定不存在”或“不能确定”);根据实验1-3判断混合物中一定不存在的离子是 。
(2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):
|
阴离子符号 |
物质的量浓度(mol·L-1) |
|
|
|
|
|
|
(3)试确定K+是否存在? ,判断的理由是
[解析](1)因溶液中可能含有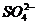 、
、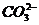 的干扰,所以不能确定原溶液中是否含有
的干扰,所以不能确定原溶液中是否含有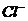 ;由实验3可知,溶液中一定含有
;由实验3可知,溶液中一定含有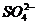 、
、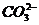 ,则由此可知,原溶液中一定不含Mg2+、Ba2+;(2)由实验3可知,BaSO4的质量为2.33g,则
,则由此可知,原溶液中一定不含Mg2+、Ba2+;(2)由实验3可知,BaSO4的质量为2.33g,则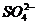 的物质的量为0.01mol,浓度是0.1mol·L-1;BaCO3的质量为6.27g-2.33g=3.94g,
的物质的量为0.01mol,浓度是0.1mol·L-1;BaCO3的质量为6.27g-2.33g=3.94g, 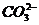 的物质的量为0.02mol,浓度是0.2mol·L-1;(3)由实验2、3可知,溶液中一定含有NH4+、
的物质的量为0.02mol,浓度是0.2mol·L-1;(3)由实验2、3可知,溶液中一定含有NH4+、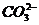 和
和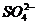 ,经计算,NH4+的物质的量为0.05mol
,经计算,NH4+的物质的量为0.05mol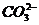 、
、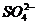 的物质的量分别为0.02mol和0.01mol,根据电荷守恒,得K+一定存在。
的物质的量分别为0.02mol和0.01mol,根据电荷守恒,得K+一定存在。
[答案](1)不能确定;Ba2+、Mg2+;(2)
|
阴离子符号 |
物质的量浓度(mol·L-1) |
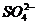 |
0.1 |
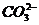 |
0.2 |
(3)存在:溶液中肯定存在离子是NH4+、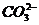 和
和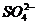 。经计算,NH4+的物质的量为0.05mol
。经计算,NH4+的物质的量为0.05mol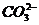 、
、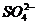 的物质的量分别为0.02mol和0.01mol,根据电荷守恒,得K+一定存在。
的物质的量分别为0.02mol和0.01mol,根据电荷守恒,得K+一定存在。
21世纪教育网
4. (海南省陵水县2007-2008学年度高三上学期第二次摸底考试)欲使NaCl、NH4Cl和SiO2的混合物分开,其必要的操作为
A.升华、溶解、过滤、蒸发 B.溶解、过滤、蒸发、分液
C.加热、溶解、过滤、结晶 D.溶解、过滤、分馏、结晶
[解析]利用NaCl、NH4Cl和SiO2的化学性质,先加热使NH4Cl分解再化合,然后加水溶解,过滤出SiO2,最蒸发结晶滤液得到NaCl。
[答案]C
3. (福建安溪八中2009届高三7月份质量检测试题)现有如下5种无色溶液:NaAlO2、KOH、NaCl、MgCl2、稀氨水,若要将其一一鉴别开来,至少需要用多少种试剂
A.1种 B.2种 C.3种 D.不用试剂
[解析]依据题目中的5种溶液,首先闻到有刺激性气味的是稀氨水,然后取剩余的四种溶液少许,分别向其中滴加氨水,有白色沉淀产生的是MgCl2溶液,最后取剩余的三种溶液少许,分别向其中滴加AlCl3溶液,一开始产生白色沉淀的是NaAlO2,一开始无沉淀随着AlCl3溶液滴加又产生白色沉淀的是KOH,一直无明显现象的是NaCl。因此要将其一一鉴别开来,至少需要用1种试剂即可。
[答案]A
2.(福建省南安华侨中学2009届高三上学期第二次月考)下列说法正确的是
A.苯酚、硫氰化钾、乙酸、氢氧化钾四种溶液可用FeCl3溶液一次鉴别
B.CH3CH2OH、CH2=CHCOOH、CH3CHO、CH3COOH四种溶液可用新制Cu(OH)2一次鉴别
C.除去KCl溶液中的少量MgCl2:加入适量的NaOH溶液,过滤
D.KCl溶液中混有少量KI,可通入足量Cl2后,再用乙醇进行萃取、分液
[解析]A项中苯酚遇FeCl3溶液呈紫色,硫氰化钾遇FeCl3溶液呈血红色,乙酸遇FeCl3溶液无明显现象,氢氧化钾遇FeCl3溶液产生红褐色沉淀,故可用FeCl3溶液将四种溶液一次鉴别出;B项中CH2=CHCOOH和CH3COOH均使新制Cu(OH)2溶解,二者不易鉴开;C项中除去Mg2+又混入Na+;D项中乙醇不能作萃取剂,因其与水任意比互溶。
[答案]A
1.(福建安溪八中2009届高三7月份质量检测试题)用过量的H2SO4、NaOH、NH3·H2O、NaCl等溶液,按题图所示步骤分开五种离子。则溶液①、②、③、④是

A.①NaCl ②NaOH ③NH3·H2O ④H2SO4
B.①H2SO4 ②NaOH ③NH3·H2O ④NaCl
C.①H2SO4 ②NH3·H2O ③NaOH ④NaCl
D.①NaCl ②NH3·H2O ③NaOH ④H2SO4
[解析]从题目所给的图示步骤综合分析,可以看出第①步分离五种离子中的一种离子,只能是Ag+与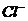 结合生成AgCl沉淀。第②步产生的沉淀和剩余的溶液分别分离出两种离子,应用NH3·H2O沉淀出Fe3+和Al3+,然后用强碱NaOH溶液将Fe(OH)3和Al(OH)3分离。第④步用
结合生成AgCl沉淀。第②步产生的沉淀和剩余的溶液分别分离出两种离子,应用NH3·H2O沉淀出Fe3+和Al3+,然后用强碱NaOH溶液将Fe(OH)3和Al(OH)3分离。第④步用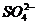 将Ba2+和K+分离,故答案为D21世纪教育网
将Ba2+和K+分离,故答案为D21世纪教育网
[答案]D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com