
1.I.短周期某主族元素M的电离能情况如图(A)所示。则M元素位于周期表的第 族。

II.图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第 族元素氢化物的沸点的变化规律。不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线--折线a和折线b,你认为正确的是: ,理由是: 。
 III.人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属则被科学家预测为是钛(Ti)。钛被誉为“未来世纪的金属”。试回答下列问题:
III.人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属则被科学家预测为是钛(Ti)。钛被誉为“未来世纪的金属”。试回答下列问题:
(1)22Ti元素基态原子的价电子层排布式为 。
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定。偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构示意图如右图,则它的化学式是 。
(3)现有含Ti3+的配合物,化学式为[TiCl(H2O)5]Cl2·H2O。配离子[TiCl(H2O)5]2+中含有的化学键类型是 ,该配合物的配体是 。
2.几种类型的晶体的比较
|
晶体类型 |
金属晶体 |
离子晶体 |
原子晶体 |
分子晶体 |
|
|
结 构 |
构成微粒 |
金属阳离子和自由电子 |
阴、阳离子 |
原子 |
分子 |
|
微粒间作用力 |
金属键 |
离子键 |
共价键 |
分子间作用力 |
|
|
性 质 |
熔、沸点 |
随金属键强弱变化,差别较大 |
较高 |
很高 |
较低 |
|
硬度 |
随金属键强弱变化,差别较大 |
较大 |
很大 |
较小 |
|
|
导电性 |
良好 |
水溶液和熔融状态能导电 |
一般不导电 |
一般不导电 |
|
|
举例 |
所有固态金属 |
NaCl、CsCl、CaF2 |
金刚石、晶体硅、SiO2 |
干冰、冰、I2 |
试题枚举
HN3称为叠氮酸,常温下为无色有刺激性气味的液体。N3-也被称为类卤离子。用酸与叠氮化钠反应可制得叠氮酸。而叠氮化钠可从下列反应制得:NaNH2+N2O=NaN3+H2O。HN3、浓盐酸混合液可溶解铜、铂、金等不活泼金属,如溶解铜生成CuCl2-。铜和铂的化合物在超导和医药上有重要应用,Cu的化合物A(晶胞如图)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中B异构体具有可溶性,可用于治疗癌症。试回答下列问题:
(1)基态铜原子核外电子排布式为 。
(2)元素N、S、P的第一电离能(I1)由大到小的顺序为 。
(3)HN3属于 晶体,N3-的空间构型是_____,与N3-互为等电子体的分子的化学式为 (写1种)。NH2-的电子式为 ,其中心原子的杂化类型是 。
(4)CuCl2-中的键型为 ,超导氧化物A的化学式为
(5)治癌药物B的结构简式为
[解析] (1)根据铜的原子序数和构造原理可写出:1s22s22p63s23p63d104s1或[Ar]3d104s1
(2)同主族元素,从上到下第一电离能逐渐减小,N和P原子的外层电子构型具有较稳定的p3半满结构,第一电离能比硫的大,则N、S、P的第一电离能(I1)由大到小的顺序为:N>P>S
(3)分子,直线,CO2
(N2O、CS2,写1个即可),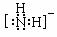 sp3
sp3
(4)配位键(写共价键也可) 根据晶胞中顶点、面、体心的分配关系,A的化学式为YBa2Cu3O7
(5)B异构体具有可溶性,说明其为极性分子:
[变式反馈]
1.氢键对物质性质的影响
分子间氢键使物质的熔沸点升高,使物质的溶解性增强;分子内氢键一般使物质的熔沸点降低。
分子间氢键
8.金属原子在空间的堆积方式
钠、钾、铬、钨等 体心立方堆积 |
镁、钛、锌等 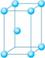 六方堆积 |
金、银、铜、铝等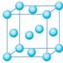 面心立方堆积 |
分子间作用力与物质的性质
7.金属键对金属通性的解释
|
金属通性 |
解释 |
|
金属光泽 |
金属中的自由电子能在一定范围内自由活动,无特征能量限制,可以在较宽范围内吸收可见光并随即放出,因而使金属不透明、具一定金属光泽(多数为银白色)。 |
|
导电 |
在外加电场的作用下,自由电子在金属内部发生定向运动,形成电流。 |
|
导热 |
自由电子把能量从温度高的区域传到温度低的区域,从而使整块金属达到同样的温度。 |
|
有延展性 |
当金属受到外力作用时,金属原子之间发生相对滑动,表现为良好的延展性。 |
6.典型离子晶体的结构特征
|
NaCl型晶体 |
CsCl型晶体 |
 每个Na+离子周围被六个C1-离子所包围,同样每个C1-也被六个Na+所包围。 |
 每个正离子被8个负离子包围着,同时每个负离子也被8个正离子所包围。 |
5.简单配合物
|
概念 |
表示 |
条件 |
|
共用电子对由一个原子单方向提供给另一原子共用所形成的共价键。 |
 A
B A
B电子对给予体 电子对接受体 |
其中一个原子必须提供孤对电子,另一原子必须能接受孤对电子的轨道。 |
4.等电子原理及其应用
等电子体:原子数相同,价电子数也相同的微粒,如:CO和N2,CH4和NH4+;等电子体具有相似的化学键特征,性质相似。
3.价层电子对互斥模型判断简单分子或离子的空间构型
|
电子对数 目 |
电子对的空间构型 |
成键电子对数 |
孤电子
对 数 |
电子对的
排列方式 |
分子的
空间构型 |
实 例 |
|
2 |
直 线 |
2 |
0 |
 |
直 线 |
CO2、C2H2 |
|
3 |
三角形 |
3 |
0 |
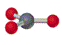 |
三角形 |
BF3、SO3 |
|
2 |
1 |
 |
V-形 |
SnCl2、PbCl2 |
||
|
4 |
四面体 |
4 |
0 |
 |
四面体 |
CH4、SO42- CCl4、NH4+ |
|
3 |
1 |
 |
三角锥 |
NH3、PCl3 |
||
|
2 |
2 |
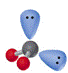 |
V-形 |
H2O、H2S |
2.多原子分子(离子)的立体结构
|
化学式 |
中心原子孤对电子对数 |
杂化轨道数 |
杂化轨道类型 |
分子结构 |
|
CH4 |
0 |
4 |
sp3 |
正四面体 |
|
C2H4 |
0 |
3 |
sp2 |
平面三角形 |
|
BF3 |
0 |
3 |
sp2 |
平面三角形 |
|
CH2O |
0 |
3 |
sp2 |
平面三角形 |
|
C2H2 |
0 |
2 |
sp |
直线型 |
|
CO2 |
0 |
2 |
sp |
直线型 |
|
NH3 |
1 |
4 |
sp3 |
三角锥形 |
|
NH4+ |
0 |
4 |
sp3 |
正四面体 |
|
H2O |
2 |
4 |
sp3 |
V形 |
|
H3O+ |
1 |
4 |
sp3 |
三角锥形 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com