
4. 在100mL 36.5%的浓盐酸(密度为1.18g/cm3)中加入多少mL 2mol/L的稀盐酸(密度为1.08g/cm3),才能配成6mol/L的盐酸(密度为1.10g/cm3)。
分析:任何溶液在稀释时,溶液和溶剂的量都要发生变化,但溶质的量不变,据此可以得到稀释下列各种浓度的溶液计算公式。
百分比浓度溶液的稀释公式:
浓溶液的质量×浓溶液的浓度 = 稀溶液的质量×稀溶液的浓度
mol尔浓度的溶液稀释公式:
浓溶液的浓度×浓溶液的体积(L) = 稀溶液的浓度×稀溶液的体积
同一溶质的两种不同浓度的溶液混合时,混合溶液的浓度介于溶液之间,混合液跟两原溶液中溶质、溶液量的基本关系是:
(1)混合液中所含溶质的总量等于两原溶液的溶质质量之和。
(2)混合溶液的质量等于两原溶液的质量之和,但体积不等于两原溶液的体积之和(当两原溶液很稀时,通常把混合液的体积近似地看做两原溶液的体积之和。)
在应用上述关系进行复杂的混合溶液计算时,可先算出混合溶液的总质量和溶质的总质量,然后再求出混合溶液的浓度。
设需加入VmL 2mol/L的盐酸
混合液中溶质的总物质的量

混合溶液的总体积:
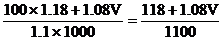
混合液的物质的量浓度:
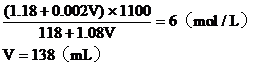
答:略
3. 金属锡的纯度可以通过下述方法分析:将试样溶于盐酸,反应的化学方程式为:Sn+2HCl=SnCl2+H2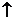 再加入过量的FeCl
再加入过量的FeCl 溶液,发生如下反应:SnCl2+2FeCl
溶液,发生如下反应:SnCl2+2FeCl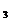 =SnCl4+2FeCl2最后用已知浓度的K2Cr2O7溶液滴定生成Fe2+,反应的化学方程式为:
=SnCl4+2FeCl2最后用已知浓度的K2Cr2O7溶液滴定生成Fe2+,反应的化学方程式为: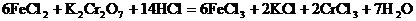 现有金属锡试样0.613g,经上述反应后,共用去0.100 mol/LK2Cr2O7溶液16.0mL。求试样中锡的百分含量(假定杂质不参加反应)。
现有金属锡试样0.613g,经上述反应后,共用去0.100 mol/LK2Cr2O7溶液16.0mL。求试样中锡的百分含量(假定杂质不参加反应)。
分析:该题是应用关系式法解多步反应的综合计算。根据题目所给出的三个化学反应,得出Sn与K2Cr2O7的物质量的关系。
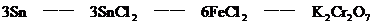
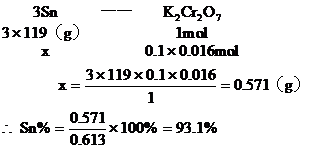
答:略。
巩固联系
2. 某化工厂用NH3制备NH4NO3。已知NH3制NO的产率是96%;NO制HNO3的产率是92%,HNO3与NH3反应生成NH4NO3。则制HNO3所用去NH3的质量占总耗NH3的质量的百分比是多少?(不考虑生产上的其它损耗)
分析:根据反应
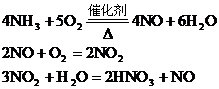
由于生产中NO2与H2O反应生成HNO3和NO,不断地补充空气使NO多次被氧化成NO2,被水吸收,最后比较完全转化HNO3,因此,第三步反应在考虑到循环反应后可用下式表示:
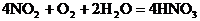
由以上四个反应可得最初反应物与最终产品的关系式:
4NH3-4NO-4NO2-4HNO3
设生产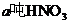 耗用NH3为x吨,生产NH4NO3耗用NH3 y吨
耗用NH3为x吨,生产NH4NO3耗用NH3 y吨

生产HNO3耗用NH3的质量百分比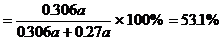
答:略。
0.02mol 0.02mol
根据反应耗用盐酸的量列方程求解
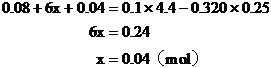
Fe2O3的质量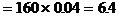 (g)
(g)
Fe的质量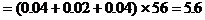 (g)
(g)
解法二:
设混合物中含铁的物质的量为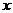 ,Fe2O3的物质的量为
,Fe2O3的物质的量为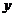
根据氧化还原反应中的电子守恒
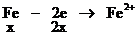
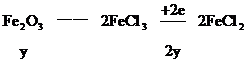
2H+--H2得电子的物质的量0.04×2(mol)
CuO--Cu得电子的物质的量0.02×2(mol)
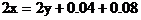
根据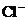 守恒列方程
守恒列方程
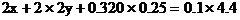
解方程组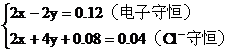

Fe的质量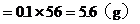
Fe2O3的质量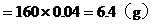
1. 将Wg铁、氧化铁和氧化铜组成的混合物粉未放入100mL 4.4mol/L盐酸中,反应完全后得氢气896mL(标况),生成的溶液中只有FeCl2、HCl和1.28g固体。把溶液稀释到320mL时,盐酸的物质的量浓度为0.25mol/L,求混合物中各物质是多少g?
分析:解答此题的关键,是审清题意,找出等量关系,选准突破口。首先确定由生成溶液中的盐酸可知反应后的1.28g固体沉淀物为铜,因此可首先确定CuO的质量。再根据各反应化学方程式中诸物质的量的关系和耗用盐酸的物质的量列方程求解,或寻求题中“隐含”的电子守恒和Cl-守恒条件,求得Fe和Fe2O3的质量。
解法一:
Cu的物质的量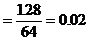 mol
mol
CuO的质量=0.02×80=1.6(g)
设混合物中Fe2O3的物质的量为x。
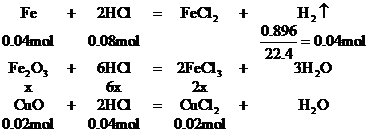
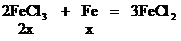
 CuCl2 +
Fe = FeCl2 +Cu
CuCl2 +
Fe = FeCl2 +Cu
8、时间不够充裕。
化学计算是学生必须掌握的基本技能之一。而思维能力较差的学生就是害怕计算,其原因是:一、对计算所依托的基本化学原理和性质不熟悉;二、对基本的计算技能掌握不到位;三、思维不灵活,不会审题,不会寻找解题的突破口,不会分析问题,也就不会解决问题。要求教师加强解题策略相关知识的教学;加强学科问题解决的研究。
试题枚举
7、表达不够清楚;
6、格式不够规范;
5、运算不够准确;
3、思考不够全面;
八个“不够” 4、思维不够灵敏;
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com